Periodni sustav elemenata

Periodni sustav elemenata je sustavni tablični poredak kemijskih elemenata koji odražava njihovu atomsku građu i sličnost njihovih fizikalnih i kemijskih svojstava. Periodičkomu ponavljanju kemijskih i fizikalnih svojstava elemenata uzrok je periodička sličnost elektronske konfiguracije atoma elemenata poredanih po rastućem atomskom broju. Nova perioda u periodnom sustavu započinje kada se u elektronskoj konfiguraciji atoma počne popunjavati nova elektronska ljuska. Stoga atomi elemenata u jednoj periodi imaju jednak broj ljusaka, ali različit broj elektrona u vanjskoj ljusci (valentni elektroni). Suprotno, atomi elemenata unutar jedne skupine (stupac) imaju različit broj ljusaka, ali im je broj valentnih elektrona jednak. Kako broj valentnih elektrona određuje kemijska svojstva elementa, elementi jedne skupine imaju slična kemijskih svojstva.[1]
Glavne skupine periodnoga sustava
Glavne skupine periodnoga sustava jesu: 1., 2., 13., 14., 15., 16., 17. i 18. skupina:
- elementi 1. skupine (osim vodika) nazivaju se alkalijski metali, jer tvore jake baze ili lužine (alkalije).
- elementi 2. skupine su zemnoalkalijski metali, jer također tvore jake lužine, a uz to su sastojci Zemljine kore.
- elementi od 3. do 11. skupine zovu se prijelazni metali, jer tvore prijelaz između lijeve i desne strane tablice.
- elementi 12. skupine, cink, kadmij i živa, nemaju posebno ime.
- elementi 13., 14. i 15. skupine nazivaju se prema prvom elementu u skupini: borova (13.), ugljikova (14.) i dušikova (15.) skupina.
- elementi 16. skupine su halkogeni elementi, jer ulaze u sastav ruda.
- elementi 17. skupine zovu se halogeni elementi, jer s metalima tvore soli,
- elementi 18. skupine nazivaju se plemeniti plinovi, jer u uobičajenim uvjetima ne reagiraju ni s jednim elementom.
- unutar šeste periode nalazi se niz kemijski vrlo sličnih elemenata, od atomskoga broja 57 do 71, koji se prema prvom članu niza, lantanu, nazivaju lantanoidi.
- unutar sedme periode nalazi se niz također kemijski vrlo sličnih elemenata, od atomskoga broja 89 do 103, a prema prvom članu niza, aktiniju, zovu se aktinoidi. Lantanoidi i aktinoidi nazivaju se i unutrašnji prijelazni elementi i zbog preglednosti najčešće se prikazuju posebno, na dnu tablice. Skandij, itrij i lantanoidi zajedno se nazivaju i rijetki zemni elementi.
Sustav
Suvremena tablica periodnoga sustava, prema preporuci Međunarodne unije za čistu i primijenjenu kemiju (IUPAC, 1988.), sadrži 7 perioda i 18 skupina elemenata. Svi su elementi u periodnome sustavu naznačeni svojim kemijskim simbolima, kojima se dodaju oznake: atomski broj (redni broj) kao lijevi supskript, a maseni broj kao lijevi superskript.
| Skupina → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ↓ Perioda | ||||||||||||||||||||
| 1 | 1 H |
2 He | ||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | ||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | ||
| 6 | 55 Cs |
56 Ba |
* |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | ||
| 7 | 87 Fr |
88 Ra |
** |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | ||
| * Lantanoidi | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | |||||
| ** Aktinoidi | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | |||||
| Alkalijski metali1 | Zemnoalkalijski metali1 | Lantanoidi1,2 | Aktinoidi1 | Prijelazni metali1 |
| Slabi metali1 | Polumetali | Nemetali | Halogeni elementi3 | Plemeniti plinovi3 |
- Alkalijski, zemnoalkalijski, prijelazni metali, lantanoidi, aktinoidi i slabi metali zajedno se zovu kovine.
- Lantanoidi, skandij i itrij zajedno nose naziv rijetki zemni metali.
- Halogeni elementi i plemeniti plinovi su tekođer nemetali.
Stanje pri normalnom tlaku i sobnoj temperaturi: Atomski brojevi elemenata u plinovitom stanju su crvene boje, elemenata u tekućem stanju zelene, a elemenata u krutom stanju crne boje.
Prirodna svojstva: Elementi s punim okvirom imaju stabilne izotope starije od Zemlje (primordijalni elementi). Elementi s iscrtkanim okvirom nastaju prirodno od drugih elemenata, ali imaju samo izotope s vremenom poluraspada mnogo kraćim od starosti Zemlje pa se mogu naći tek u radioaktivnim rudama. Elementi s istočkanim okvirom su umjetni elementi.
Elektronska konfiguracija
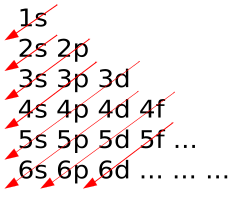
Kako struktura periodnoga sustava ovisi o elektronskoj konfiguraciji atoma elemenata, periode sadrže različit broj elemenata. Prva elektronska ljuska može primiti samo dva elektrona, pa 1. perioda ima samo dva elementa, vodik i helij, koji svojim elektronima popunjavaju 1. ljusku, to jest 1s podljusku. Druga perioda može primiti 8 elektrona, pa ima 8 elemenata koji popunjavaju 2. ljusku, to jest 2s i 2p podljuske. Treća perioda također može primiti 8 elektrona, pa ima također 8 elemenata koji popunjavaju 3. ljusku, to jest 3s i 3p podljuske. Četvrta perioda ima 18 elemenata, koji popunjavaju 4. ljusku i nedovršenu 3. ljusku, to jest redom 4s, 3d i 4p podljuske. Peta je perioda također s 18 elemenata, koji popunjavaju 5. ljusku i nedovršenu 4. ljusku, to jest redom 5s, 4d i 5p podljuske. Šesta perioda ima 32 elementa koji popunjavaju 6. ljusku i nedovršene 4. i 5. ljusku, to jest redom 6s, 4f, 5d i 6p podljuske. Sedma je perioda nedovršena i ima 26 elemenata, jer preostalih 6 (do 32) nisu otkriveni. Tih 26 elemenata popunjavaju 7. ljusku i nedovršene 5. i 6. ljusku, to jest redom 7s, 6d i 5f podljuske.
Izgradnja periodnog sustava elemenata
Za izgradnju kemijskih elemenata osnovno značenje pripada Paulijevu načelu, po kojemu pojedino stacionarno stanje u atomu može biti zaposjednuto samo od jednog elektrona. Prije nego što povučemo opće zaključke iz Paulijeva načela, predočit ćemo kako se postepeno izgrađuju kemijski elementi počevši od vodika. Od elemenata do elemenata pridolazi jedan elektron i morat ćemo uvijek razmisliti kuda da stavimo novi elektron.
Na početku periodnog sustava stoji vodik. U stabilnom stanju kreće se elektron u K ljuski i ima kvantne brojeve n = 1, l = m = 0 i s = 1/2.
Kuda da stavimo drugi helijev elektron? Naravno, u prazno energijsko najniže stanje. K ljuska sadrži još jedno stacionarno stanje, gdje spin ima antiparalelan položaj. Drugi elektron helija poprima, prema tome kvantne brojeve n = 1, l = m = 0 i s = - 1/2. Kako se vidi, oba helijeva elektrona kreću se u istoj stazi oko atomske jezgre, ali im vlastiti momenti impulsa stoje suprotno. Spini obaju elektrona poništavaju se među sobom, pa helijev atom ne smije imati ni impuls vrtnje ni magnetski moment. Pokusima je to potvrđeno.
Helijeva dva elektrona potpuno ispunjuju K ljusku. Litijev treći elektron prelazi u L ljusku. On ima kvantne brojeve n = 2, l = m = 0 i s = 1/2. Vanjski elektron litija kreće se daleko izvan K ljuske, pa tako litijev atom ima znatno veći promjer. Litij ima magnetski moment, koji potječe od spina vanjskog elektrona.
Kod idućeg elementa, berilija, dolazi još jedan elektron u L ljusku. Taj elektron razlikuje se od prvog s antiparalelnim položajem spina. Njegovi su kvantni brojevi n = 2, l = m = 0 i s = - 1/2. Vidi se da vanjska ljuska berilija nalikuje na helijevu elektronsku konfiguraciju. Time se objašnjava da berilij ima sličan s helijem, a nema kao ni helij magnetskog momenta.
L ljuska sadrži još kvantna stanja, gdje je impuls vrtnje l = 1. Kod petog elementa po redu, bora, treći elektron u vanjskoj ljuski poprima taj impuls vrtnje. Tri vanjska elektrona određuju valentnost bora, a treći vanjski elektron impuls vrtnje i magnetski moment.
Kod impulsa vrtnje l = 1 može magnetski kvantni broj m poprimiti vrijednost - 1, 0 i + 1. Pored toga može se spin postaviti paralelno i antiparalelno. Kako vidimo, imamo 6 različitih kvantnih stanja. Kvantni brojevi tih stanja jesu:
| glavni kvantni broj | orbitalni kvantni broj | magnetni orbitalni kvantni broj | magnetni spinski kvantni broj |
|---|---|---|---|
| n = 2 | l = 1 | m = + 1 | s = - 1/2 |
| n = 2 | l = 1 | m = 0 | s = - 1/2 |
| n = 2 | l = 1 | m = - 1 | s = - 1/2 |
| n = 2 | l = 1 | m = + 1 | s = + 1/2 |
| n = 2 | l = 1 | m = 0 | s = + 1/2 |
| n = 2 | l = 1 | m = - 1 | s = + 1/2 |
Ova kvantna stanja popunjuju redom elementi: bor, ugljik, dušik, kisik, fluor i neon. Posljednji element, neon, ima L ljusku dva elektrona sa l = 0 i 6 elektrona sa l = 1. Njegovi elektroni popunili su sasvim drugu ljusku. Vidimo opet da "plemeniti" potječe od popunjenosti vanjske ljuske. Osim toga, neon nema magnetskog momenta. Magnetski momenti njegovih 6 elektrona u svakom se smjeru poništavaju. Na elektron sa m = + 1 dolazi elektron sa m = - 1, a isto tako na s = + 1/2 dolazi s = - 1/2.
Neon ima 2 elektrona u K ljuski, a 8 u L ljuski. Kod jedanaestog po redu elementa, natrija, mora jedanaesti elektron prijeći u M ljusku. Vanjski elektron ima kvantne brojeve n = 3, l = m = 0 i s = + 1/2. Ovaj elektron, koji se podaleko kreće izvan popunjenih unutarnji ljusaka, prouzrokuje svojstva alkalijskih metala. Dvanaesti po redu element, magnezij, ima još jedan elektron u M ljuski. Staza tog drugog elektrona ista je kao i u prvog, samo što njegov spin stoji suprotno. Poput helija i berilija nema magnezij magnetskog momenta.
| Čvrsti | Broj stanja |
|---|---|
| s, m, l, n | 1 |
| m, l, n | 2 |
| l, n | 2∙(2∙l + 1) |
| n |
Suma u posljednjem redu tablice proračunata je jednostavno:
U ljuski s glavnim kvantnim brojem n ima mjesta za 2∙n2 elektrona. Taj rezultat je od osnovnog značenja za periodni sustav.
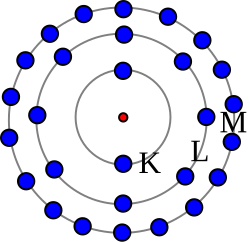
Stavljajući za glavni kvantni broj redom vrijednosti 1, 2, 3, 4, …, dobivamo najveći broj elektrona u različitim ljuskama. Popunjene ljuske sadrže elektrona:
| K | L | M | N |
|---|---|---|---|
| 2∙12 = 2 | 2∙22 = 8 | 2∙32 = 18 | 2∙42 = 32 |
K ljuska bila je ispunjena helijem, a L ljuska neonom. Ti elementi odista slijede u razmaku 2 i 8. Prva bi sad bila misao da se daljnja izgradnja elemenata vrši tako da se iduća M ljuska postepeno popuni elektronima. Vidjeli smo da to zaista tako ide do argona s rednim brojem 18. Međutim, dalje to ne ide više tako. Iako u M ljuski još ima mjesta za 10 elektrona, kod idućeg elementa, kalija, devetnaesti elektron prelazi u N ljusku. Razlog tome je što su energetski nivoi M ljuske sa l = 2 viši od energetskih nivoa N ljuske sa l = 0. U N ljuski staza l = 0 ulazi u unutarnje ljuske, kako smo vidjeli kod alkalijskih spektara, pa je elektron znatno čvršće vezan. U toj stazi mogu se kretati dva elektrona sa suprotnim smjerom spina. Takvu vanjsku konfiguraciju elektrona ima kalcij. On pripada metalima alkalijskih metala i ima dva elektrona u vanjskoj N ljuski. Idući element skandij s rednim brojem 21 stavlja svoj dvadeset i prvi elektron u M ljusku, koju su kalij i kalcij preskočili. Impulsu vrtnje l = 2 pripada 10 kvantnih stanja. Ta se kvantna stanja, počevši sa skandijem, postepeno popunjuju elektronima.
Zanimljivo je promatrati N ljusku. Kod nje kripton s rednim brojem 36 popunjuje dvije najniže podljuske l = 0 i l = 1. Trideset i sedmi elektron idućeg elementa, rubidija, preskače obje podljuske l = 2 i l = 3 u ljuski N i ide u O ljusku. Isto to čini i trideset i osmi element. Međutim, s trideset i devetim elementom počinje se opet popunjavati N ljuska i elektroni se smještaju u njenu podljusku l = 2. Kad se ta podljuska popuni, ne smještaju se novi elektroni u podljusku l = 3 ljuske N, nego prelaze u podljusku l = 1 ljuske O. Ta se podljuska popuni plemenitim plinom ksenonom. Sad opet nastupa jedan veliki skok, jer slijedeći element, cezij, stavlja svoj pedeset i peti elektron u P ljusku. Isto to čini i barij. Pedeset i sedmi element, lantan, stavlja svoj jedan elektron u O ljusku. Tek odsada počinje se postepeno ispunjavati slobodna, zadnja podljuska preskočene N ljuske. Ta podljuska sa l = 3 sadrži 14 kvantnih stanja. No, toliko upravo ima rijetkih zemalja koje se nadovezuju na lantan. Sad razumijemo zašto su ti elementi tako kemijski srodni. Četrnaest elektrona ugrađuje se sukcesivno duboko u unutarnjim ljuskama. Atomska periferija ostaje pri tom u bitnom nepromijenjena. Zbog toga su slična sva svojstva rijetkih zemalja, koja ovise o periferiji atoma. Isto tako vidimo da ne može biti više od 14 rijetkih zemalja. Kod sedamdeset i drugog elementa, hafnija, prelazi već novi elektron u O ljusku.
Pri izgradnji periodnog sustava moramo imati dvoje pred očima. S jedne strane ljuske omataju jezgru onim redom kako idu slova abecede K, L, M, N, O, P i Q. No s druge strane, podljuske l = 0 i l = 1 viših ljusaka mogu imati nižu energiju nego podljuske l = 2 i l = 3 ili l = 4 prethodnih ljusaka. Zbog toga se izgradnja elemenata, kad idemo postepeno od vodika do uranija, ne vrši besprekidno na prvoj nepopunjenoj ljuski, nego se izvjesne podljuske preskoče, pa zatim grupe elemenata popunjuju preskočena kvantna stanja u unutarnjim ljuskama. Na osnovu toga možemo shvatiti sve zakonitosti u periodnom sustavu elemenata. [2]
Povijest
Sustav je nastao kao rezultat nastojanja mnogih kemičara da nađu što prikladniji način da se kemijski elementi poredaju tako da sličnosti među njima budu što uočljivije. Preteče otkrivanja periodnoga sustava elemenata bili su A. L. Lavoisier (potkraj 18. stoljeća), W. Prout (1815.), J. W. Döbereiner (1829.), Max Joseph von Pettenkofer (1850.), W. Odling (1857.), S. Cannizzaro (1858.), A. B. de Chancourtois (1862.) i J. A. R. Newlands (1864.).
Izvorni je sustav stvoren kad se još nije znao sastav atoma: ako se elementi slože po atomskoj masi, a zatim se neke druge osobine stave uz atomsku masu, javlja se periodno kretanje tih osobina kao funkcija atomske mase. Prvi je to primijetio njemački kemičar J. W. Döbereiner, koji je 1829. zapazio određeni broj trijada sličnih elemenata:
| Neke trijade | ||
|---|---|---|
| Element | Atomska masa | Gustoća |
| klor | 35.5 | 0.00156 g/cm3 |
| brom | 79.9 | 0.00312 g/cm3 |
| jod | 126.9 | 0.00495 g/cm3 |
| kalcij | 40.1 | 1.55 g/cm3 |
| stroncij | 87.6 | 2.6 g/cm3 |
| barij | 137 | 3.5 g/cm3 |
Zatim je engleski kemičar J. A. R. Newlands 1865. otkrio da se elementi slične vrste pojavljuju u razmacima od 8 elemenata, što je usporedio s glazbenom oktavom, ali suvremenici su ismijali njegov zakon oktava.
Pravi otkrivači periodnoga sustava
Pravi su otkrivači periodnoga sustava D. I. Mendeljejev i J. L. von Meyer. Oni su, neovisno jedan o drugom, sastavili tablicu periodnoga sustava, iako ju je Mendeljejev objavio godinu dana prije (1869.) i prvi je uvidio puni smisao tog otkrića, ostavljajući u tablici prazna mjesta za elemente koji će se tek otkriti.
Redajući elemente prema rastućim relativnim atomskim masama (tada atomskim težinama), dobili su poredak u kojem su se u periodičnim razmacima nalazili elementi sličnih kemijskih svojstava. Taj je poredak bio gotovo istovjetan s današnjim poretkom dobivenim redanjem elemenata po rastućem atomskom broju. Iznimka su bili parovi 18Ar - 19K, 27Co - 28Ni, 52Te - 53J, 90Th - 91Pa i 92U - 93Np, u kojima prvi element ima manji atomski broj, ali veću relativnu atomsku masu. Razlog je te nepravilnosti taj što se elementi sastoje od izotopa, pa je u izotopnoj smjesi nekih elemenata (na primjer kalija) najobilniji lakši izotop, a kod drugih (na primjer argona) najobilniji je teži izotop. Zbog toga je srednja vrijednost relativne atomske mase kalija (39,098) manja od argona (39,948), iako je njegov atomski broj veći. Kada je Mendeljejev postavio svoj periodni zakon, bila su poznata samo 63 kemijska elementa, tako da su mnoga mjesta u tablici ostala prazna. Smatrajući da su svojstva svakog elementa određena njegovim položajem u periodnom sustavu, Mendeljejev je predvidio postojanje i svojstva tada još nepoznatih elemenata. Potonja otkrića germanija, skandija i galija potvrdila su ispravnost njegovih pretpostavki.
Iako je među mnogim pokušajima grafičkoga prikaza periodnoga sustava bilo i onih u obliku trokuta, spirale, pužnice, stošca, piramide i cilindra, danas periodni sustav elemenata ima oblik pravokutne tablice u kojoj vodoravni redci tvore periode, i to cijele ili polovične (dugi i kratki oblik periodnoga sustava), a okomiti stupci tvore skupine elemenata.
Vrste kemijskih elemenata
Kemijski elementi se prema fizikalnim i kemijskim svojstvima dijele na metale, metaloide i nemetale. Najveći broj elemenata, od 1. do 13. skupine, pripada metalima. Na desnom su kraju periodnoga sustava nemetali, a granicu među njima čine metaloidi: bor, silicij, germanij, arsen, antimon, selenij, telurij i astat. Nemetali dušik, kisik, fluor, klor, vodik i svi elementi 18. skupine su plinovi. Osim prve periode, koja započinje vodikom, sve ostale periode započinju alkalijskim elementom, metalom, a završavaju nemetalom, plemenitim plinom. Općenito, metalni značaj elemenata u periodi slabi slijeva nadesno, a u skupini jača odozgo prema dolje; nemetalni značaj mijenja se u protivnim smjerovima.
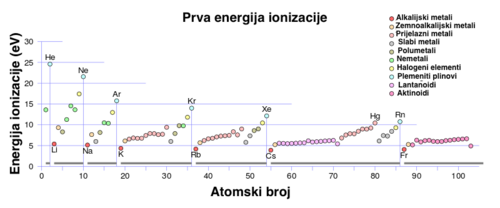
Svojstva elemenata neke periode mijenjaju se postupno od elementa do elementa, te tako postoje velike razlike u svojstvima između prvog i posljednjeg elementa iste periode. Nagle promjene svojstava nastaju između posljednjeg elementa neke periode (plemeniti plin) i prvog elementa iduće periode (alkalijski metal). Prva je pojava uvjetovana popunjavanjem već postojećih elektronskih ljusaka, a druga stvaranjem nove ljuske. Tako na primjer, prva energija ionizacije (energija potrebna da se izbaci prvi elektron iz atoma u plinovitu stanju) u 2. periodi postupno raste od 520,2 kJ/mol za litij do 2 080,6 kJ/mol za neon, pa zatim naglo pada pri prijelazu u 3. periodu na 495,6 kJ/mol za natrij. Naime, s porastom atomskoga broja kroz periodu raste električni naboj atomske jezgre, a time i privlačne sile između jezgre i elektrona, pa se elektroni sve teže odvajaju od atoma i energija ionizacije raste. Međutim, s porastom atomskoga broja u skupini raste broj ljusaka, valentni elektroni sve su udaljeniji od jezgre, pa se smanjuju privlačne sile između elektrona i jezgre, a valentni elektroni sve se lakše odvajaju od atoma i smanjuje se energija ionizacije. Dakle, iz položaja elementa u periodnome sustavu može se zaključivati o njegovim fizikalnim i kemijskim svojstvima.
Ostalo
Opća skupština Ujedinjenih naroda proglasila ju 2019. godinu Godinom Periodnog sustava elemenata uz 150.-tu obljetnicu njezina objavljivanja od Dmitrija Ivanoviča Mendeljejeva.[3]
Izvori
- ↑ periodni sustav elemenata, [1] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2018.
- ↑ Ivan Supek: "Nova fizika", Školska knjiga Zagreb, 1966.
- ↑ Vijest o proglašenju na stranicama IUPAC-a
- Ivan Filipović, Stjepan Lipanović: Opća i anorganska kemija, Školska knjiga, Zagreb, 1995.
- Nenad Raos: Periodni sustav u Hrvata, Kemija u industriji, 60 (2011) 633 - 638.
- Jasna Horvat: Roman izgrađen prema strukturi periodnog sustava elemenata, Atanor

