Plutonij
| plutonij | ||
|---|---|---|
|
| ||
| Osnovna svojstva | ||
Element Simbol Atomski broj |
plutonij Pu 94 | |
| Kemijska skupina | aktinoidi | |
| Grupa, perioda, Blok | Ac, 7, f | |
| Izgled | srebrnobijele boje Pogreška pri izradbi sličice: | |
| Gustoća1 | 19816 kg/m3 | |
| Tvrdoća | ||
| Specifični toplinski kapacitet (cp ili cV)2 |
(25 °C) 35,5 J mol–1 K–1 | |
| Talište | 639,4 [1] °C | |
| Vrelište3 | 3232 [1] °C | |
| Toplina taljenja | 2,82 kJ mol-1 | |
| Toplina isparavanja | 333,5 kJ mol-1 | |
|
1 pri standardnom tlaku i temperaturi | ||
| Atomska svojstva | ||
| Atomska masa | 244 | |
| Elektronska konfiguracija | [Rn] 5f67s2 [1] | |
Plutonij je kemijski element atomskog (rednog) broja 94 i atomske mase 244. U periodnom sustavu elemenata predstavlja ga simbol Pu. Plutonij je srebrno-bijeli metal, koji potamni u dodiru sa zrakom, stvarajući tanki sloj oksida. Taj kemijski element ima šest alotropskih modifikacija i četiri oksidacijska stanja. Reagira s ugljikom, halogenim elementima, dušikom i silicijem. Kada je izložen vlažnom zraku, stvara okside i hidride, koji povećavaju obujam uzorka i do 70%. Plutonij se taloži u tijelu u koštanoj srži i ostalim organima, gdje je vrlo opasan zbog emitiranja alfa-čestica.

Ime je dobio po patuljastom planetu Plutonu. Umjetni izotop plutonij-239 mora se spremati u nekompaktnim, odvojenim komadima manjim od 300 g jer bi inače moglo doći do kritičnosti, uz oslobađanje opasnih količina ionizirajućeg zračenja i topline.
Plutonij se koristi i kao nuklearno gorivo za nuklearne elektrane te ima visoku radioaktivnost. Plutonij se može koristiti i kao nuklearni eksploziv; 1 kilogram plutonija stvara eksploziju ekvivalentnu 20 000 tona TNT-a. Plutonij se koristio u Apollo letovima kao izvor energije za seizmičke naprave i drugu opremu koja je ostavljena na Mjesecu. Komad plutonija je topao na dodir zbog energije oslobođene alfa-raspadom.
Najvažniji izotop je plutonij-239 koji ima dugo vrijeme poluraspada od 24 110 godina i veliku primjenu za izradu nuklearnih bojnih glava, ali i za industrijsku, mirnodopsku upotrebu atomske energije u nuklearnim elektranama. Plutonij nastaje kao proizvod raspada uranija u brzim oplodnim reaktorima, u kojima se koristi neobogaćeni uranij-238. Radom reaktora neprekidno se stvara energetski visokoefikasan plutonij, koji pojačava i održava neprekinuti tijek kontrolirane nuklearne lančane reakcije.[2]
Plutonij-238 se koristi u minijaturnim nuklearnim reaktorima za napajanje svemirskih letjelica. Plutonij-240 ima visok stupanj spontane nuklearne fisije, povečavajući protok neutrona. Prisustvo plutonija-240 smanjuje učinak nuklearnog oružja i nuklearnog goriva, pa zato njegovog postotak određuje čistoću nekog nuklearnog goriva.
Veće količine (oko 20 tona godišnje) proizvode se u brzim oplodnim reaktorima, reakcijama u kojima spori (termalni) neutroni bombardiraju jezgre uranija-238 i uzrokuju njihov raspad.
Prvi put je proizveden u Berkeleyju 1940. pod vodstvom Glenna Seaborga, E.M. McMillana, J.W. Kennedyja i A.C. Wahla, bombardiranjem mete uranija deuteronom ubrzanim u ciklotronu. Proizvodnja plutonija je bio jedan od glavnih zadataka projekta Manhattan za vrijeme Drugog svjetskog rata, Druga atomska bomba, koja je pala na Nagasaki ("Debeljko"), imala je jezgru od elementarnog plutonija-239 legiranog s galijem.
Svojstva plutonija
Fizikalna svojstva
Plutonij je težak, srebrno-bijeli metal, sličnog izgleda kao nikal, ali brzo potamni u dodiru sa zrakom, stvarajući tanki sivkasti sloj oksida. Na sobnoj temperaturi ima oblik α-plutonij, što je i njegova najčešća faza. Ona je po tvrdoći i krtosti slična sivom lijevu, a samo s legirnim dodacima postaje mekša i žilavija. Za razliku od drugih metala, plutonij nije dobar provodnik topline i električne struje. Ima nisko talište (640 °C), ali zato ima izuzetno visoko vrelište (3327 °C).
Podložan je djelovanju pare, kisika i kiselina, ali ne i lužina. Elementarni plutonij čuva se u vakuumu ili u inertnoj atmosferi da se spriječe kemijske reakcije sa zrakom.[3]
Veći komad plutonija ili njegovog spoja je topao na dodir zbog energije oslobođene alfa-raspadom. Pet kilograma plutonija-239 sadrži oko 12,5 × 1024 atoma. Ima vrijeme poluraspada 24 100 godina, što znači da se svake sekunde raspadne 11,5 × 1012 atoma plutonija-239, oslobađajuci alfa-čestice s energijom 5,157 MeV, što je količina snage od 9,68 W.
Električni otpor plutonija na sobnim temperaturama je vrlo visok, što je neobično za metale. On se čak povećava na nižim temperaturama, sve do 100 K, gdje se naglo smanjuje, sve do 20 K gdje opet raste. Za razliku od drugih metala, plutoniju se povećava gustoća nakon što se otopi, i to za oko 2,5%. Blizu tališta on ima isto vrlo visoku viskoznost i površinsku napetost s obzirom na druge metale.[4][5]
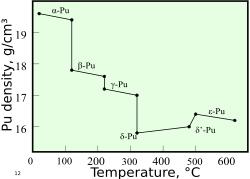
Alotropija
Plutonij ima 6 alotropskih modifikacija kod standardnog tlaka i sedmu (zeta, ζ) na višim temperaturama i samo u uskom području. Te alotropske modifikacije koje imaju različitu strukturu, imaju vrlo sličnu unutarnju energiju, ali se gustoća znatno mijenja i kristalna rešetka. Zato je plutonij vrlo osjetljiv na promjene temperature, tlaka i na različite kemijske reakcije, kada mu se obujam može znatno promijeniti. Gustoća se na primjer mijenja od 16,00 g/cm3 do 19.86 g/cm3.[6]
Na sobnoj temperaturi ima oblik α-plutonij, što je i njegova najčešća faza. δ -plutonij postoji na temperaturama od 310 °C do 452 °C, ali može biti i na sobnim temperaturama, ako se plutoniju doda malo galija, aluminija ili cerija, što mu omogućuje i da bude zavaren. δ -plutonij ima više metalni karakter, što ga čini po svojstvima sličnim aluminiju. Kod nuklearnih bombi, eksplozivni udarni val sabija kristalnu rešetku plutonija, što mijenja δ –plutonij u α-plutonij, pomažući da lakše dostigne superkritičnost.
Nuklearna fisija
Do nuklearne eksplozije dolazi kada se stvori tzv. kritična masa, tj. kada broj nastalih neutrona postane veći od broja apsorbiranih i izazove nuklearnu lančanu reakciju. Najvažniji je izotop plutonij-239, koji nastaje u nuklearnom reaktoru djelovanjem neutrona na uranij-238; njegovo vrijeme poluraspada iznosi 24 360 godina. Plutonij tvori slične spojeve kao i uranij. Upotrebljava se kao nuklearno gorivo i kao eksploziv u atomskim bombama.[7][8]
Plutonij-240 ima visok stupanj spontane nuklearne fisije, povečavajući protok neutrona. Prisustvo plutonija-240 smanjuje učinak nuklearnog oružja i nuklearnog goriva, pa zato njegovog postotak određuje čistoću nekog nuklearnog goriva. Plutonij za nuklearno oružje mora imati manje od 7% plutonija-240. Plutonij za nuklearne reaktore ima plutonija-240 od 7% do 19%. Plutonij s čistoćom manjom od 4% plutonija-240 koristi ratna mornarica SAD-a za nuklearno oružje. Plutonij-238 nije fisibilan, ali može stvoriti nuklearnu lančanu reakciju s brzim neutronima, stvarajuci alfa-čestice.
Izotopi
Poznato je dvadeset radioaktivnih izotopa plutonija s masenim brojevima od 228 do 247, među kojima je najstabilniji izotop plutonij-244 s vremenom poluraspada od 80,8 milijuna godina i plutonij-239 s vremenom poluraspada od 24 110 godina. Svi ostali izotopi plutonija imaju vrijeme poluraspada manje od 7000 godina. Zapaženo je da se izotopi plutonij-236, Pu-237, Pu-238, Pu-239, Pu-240, Pu-242 i Pu-244 raspadaju spontanom nuklearnom fisijom i emitiraju alfa-čestice, stvarajući izotope uranija i neptunija. Izotopi plutonija koji imaju atomsku masu veću od 244 uglavnom stvaraju beta-čestice, stvarajući americij. Plutonij-241 je polazni izotop u neptunijevom nizu radioaktivnog raspada.[9]
Plutonij-238 i Pu-239 su najviše umjetno korišteni izotopi. Pu-239 se dobiva umjetnim putem iz uranija-238 i bombardiranjem sporim neutronima, a nastaju beta-čestice i neptunij kao međuizotop.
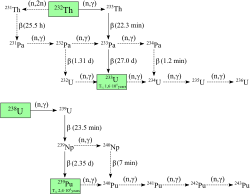
Neutroni koji nastaju nuklearnom fisijom uranija-235 budu uhvaćeni od jezgre atoma uranija-238, stvarajući tako uranij-239 i beta raspadom pretvara neutron u proton stvarajući neptunij-239 (vrijeme poluraspada 2,36 dana), pa nakon sljedećeg beta raspada nastaje plutonij-239.
Plutonij-238 nastaje bombardiranjem uranija-238 s deuterijem (D – jezgra teškog vodika):
U tom postupku, deuterij bombardira uranij-238, stvarajući dva neutrona i neptunij-238, koji spontanom nuklearnom fisijom se raspada na plutonij-238, stvarajući beta-čestice.
Toplina nuklearne fisije
Kod nuklearne fisije plutonijevih izotopa nastaje toplina nuklearne fisije. Različiti izotopi stvaraju drukčiji iznos toplinske snage po masi, a obično se izražava s W/kg ili mW/g. Svi izotopi stvaraju i slabo gama zračenje.
| Izotop | Vrsta raspada | Vrijeme poluraspada (godine) | Toplinska snaga
nuklearne fisije (W/kg) |
Neutroni koji nastaju spontanom fisijom (1/(g·s)) | Bilješke |
|---|---|---|---|---|---|
| Pu-238 | alfa-raspad u U-234 | 87,74 | 560 | 2600 | Vrlo visoka toplina nuklearne fisije. Čak i male količine uzrokuju znatno samozagrijavanje. Koristi se za radioizotopne termoelektrične generaotre. |
| Pu-239 | alfa-raspad u U-235 | 24110 | 1,9 | 0,022 | Najkorisniji radioizotop plutonija. Koristi se kao dodatak u MOX gorivima. |
| Pu-240 | alfa-raspad u U-236, samoodržavajuća fisija | 6560 | 6,8 | 910 | Zbog visoke spontane fisije sprječava korištenje u vojne svrhe, pa je njegov udjel upravo nečistoća u plutoniju koji se koristi u vojne svrhe. |
| Pu-241 | beta-raspad u Am-241 | 14,4 | 4,2 | 0,049 | Raspada se u americij-241; stvara opasnost od radijacije na starijim uzorcima. |
| Pu-242 | alfa-raspad u U-238 | 376000 | 0,1 | 1700 |
Americij-241 nastaje nuklearnom fisijom plutonija-241, a ima vrijeme poluraspada 430 godina i 1,2 samoodržavajućih fisija po gramu i u sekundi, te toplinu nuklearne fisije 114 W/kg. Taj izotop stvara vrlo prodorne gama zrake, tako da dodatno ugrožava osoblje i strukturu.
Kemijski spojevi
Plutonij u vodenoj otopini može imati oksidacijske brojeve +3, +4, +5 i +6, a spojevi u kojima je +3 i +4 su najstabilniji. Elektrolitičkom oksidacijom može se dobiti i nestabilno stanje +7. U kiselim otopinama mogu postojati razni plutonijevi ioni: ljubičasto-plavi PU3+, žuto-smeđi do zeleni Pu4+, ružičasti do narančasti PuO+ i PUO2+. Pri određenoj pH vrijednosti otopine hidroliziraju; tako npr. ioni Pu3+ hidroliziraju pri pH=7, a ioni PUO+2 pri pH=9.
Metalni plutonij proizvodi se reakcijom PuF3, bilo sa litijem, kalcijem ili barijem pri 1200 °C.
Važniji spojevi plutonija:
- Plutonijevi(III)-halogenidi (PuF3, PuCl3, PuBr3, PuI3) i plutonijevi(IV)-halogenidi (PuF4, PuCl4) dobivaju se hidrohalogenacijom plutonijevog(IV)-oksida ili plutonijevog(III)-oksalata pri temperaturi od 700 °C, jedino se PuI3 dobiva reakcijom metalnog plutonija s jodovodikom pri 40 °C.
- Plutonijev(II)-oksid (PuO) nastaje oksidacijom na površini metala izloženoj djelovanju atmosfere, a može se dobiti i izlaganjem plutonijevog oksiklorida parama barija pri temperaturi od 1250 °C.
- Plutonijev(IV)-oksid (PUO2) ima žuto-zelene do smeđe kristale. Gotovo svi spojevi plutonija prelaze u PUO2 izgaranjem u zraku pri 1000 °C.
Legure
Plutonij može stvarati legure s većinom drugih metala. Jedina iznimka su litij, natrij, kalij, rubidij, cezij (alkalijski metali), magnezij, kalcij, stroncij, barij (zemnoalkalijski metali), europij i iterbij (kovine rijetkih zemalja). Krom, molibden, niobij, tantal i volfram su topljivi u tekućem plutoniju, ali su netopljivi u krutom plutoniju. Galij, aluminij, americij, skandij i cerij mogu stabilizirati δ-plutonij na sobnoj temperaturi. Silicij, indij, cink i cirkonij omogućuju stvaranje metastabilnog δ-plutonija ako se legura brzo hladi. Velike količine hafnija, holmija i talija isto omogućuju zadržavanje dijela δ-plutonija na sobnoj temperaturi. Neptunij je jedini kemijski element koji može stabilizirati α-plutonij na višim temperaturama.[11]
Legure plutonija se mogu dobiti dodavanjem metala u talinu plutonija. Ako je rastaljeni metal dovoljno reduktivan, plutonij se može dodati u obliku oksida ili halida. δ faza legura plutonij-galij i plutonij-aluminij se dobiva dodavanjem plutonijevog(III) fluorida u rastaljeni galij ili aluminij, što ima za prednost izbjegavanje direktnog rada s visoko reaktivnim metalom plutonija. Neke od legura plutonija su:
- Legura plutonij-galij se koristi za stabiliziranje δ-plutonija, da bi se izbjegli problemi s α-plutonijem. Koristi se za nuklearno oružje s implozijom.
- Legura plutonij-aluminij može biti zamjena za leguru plutonij-galij. Problem je što ta legura kod nuklearnog oružja reagira s alfa-česticama. Legura plutonij-aluminij se može koristiti i kao dio nuklearnog goriva.
- Legura plutonij-galij-kobalt (PuCoGa5) je neuobičajeni supravodič, koji pokazuje svojstvo supravodljivosti ispod 18,5 K.
- Legura plutonij-cirkonij se može koristiti kao nuklearno gorivo
- Legura plutonij-cerij i legura plutonij-cerij-kobalt se može koristiti kao nuklearno gorivo
- Legura plutonij-uranij s oko 15-30% plutonija (molarno) se može koristiti kao nuklearno gorivo za brzi oplodni reaktor. Ta legura spada u piroforne metale i visoko je osjetljiva na koroziju zraka, tako da treba dodavati i druge metale u leguru. Dodavanjem aluminija, ugljika ili bakra se ne smanjuje osjetljivost legure značajno, dok cirkonij i željezo imaju bolja antikorozivna svojstva, ali slabi nakon nekoliko mjeseci.
- Dodavanjem titanija i/ili cirkonija se znatno smanjuje talište.
- Legure plutonij-uranij-titanij i legura plutonij-uranij-cirkonij ispitivali su se za korištenje kao nuklearno gorivo. Dodavanje trećeg elementa u leguru povećava otpornost na koroziju, smanjuje zapaljivost, povećava čvrstoću, rastezljivost i toplinsko istezanje. Legura plutonij-uranij-molibden ima najbolju otpornost na koroziju, stvarajući zaštitni oksidni film na površini, ali su titanij i cirkonij poželjniji iz fizikalnih razloga.
- Legura torij-uranij-plutonij se bila ispitivala kao gorivo za brzi oplodni reaktor.
Nalazišta
Prije umjetne sinteze u nuklearnim reaktorima, plutonij je na Zemljiv postojao samo u tragoma, kao plutonij-239 i plutonij-244, što su ostaci fisije u prirodnim nuklearnim reaktorima (rudniku Oklo na zapadu Afrike, u državi Gabon), te rijetki uhvati neutrona zbog spontane fisije uranija.
Beznačajne količine plutonija se mogu pronaći i u ljudskom tijelu, najviše zbog utjecaja nuklearnih testova i manje zbog nuklearnih nesreća.
Povijest
Otkriće
Plutonij-238 su prvi proizveli u Berkeleyju 1940. Glenn Seaborg, E.M. McMillan, J.W. Kennedy i A.C. Wahl, bombardiranjem atoma uranija deuterijem ubrzanim u ciklotronu. Iz plutonija-238 nakon dva dana je nuklearnom fisijom nastao neptunij-238, što je bio i dokaz postojanja plutonija. Otkriće nije odmah objavljeno, kada se saznalo da plutonij može ostvariti nuklearnu fisiju, korisnu za stvaranje atomske bombe. Otkriće je objavljeno nakon Drugog svjetskog rata. 1942. je izdvojen i plutonij-239. 1943. je iz plutonijevog trifluorida dobiven prvi uzorak metala plutonija.[12]
Projekt Manhattan
Projekt Manhattan bio je tajni projekt američke vlade tijekom Drugog svjetskog rata s ciljem izrade atomske bombe. Projekt je započet 1941. godine nakon što se strahovalo da bi ju i tadašnja nacistička Njemačka mogla izraditi. U američkom gradiću Los Alamos okupljeni su ponajbolji fizičari i inženjeri i pod vodstvom američkog fizičara Roberta Oppenheimera izradili su i uspješno testirali prvu atomsku bombu 16. srpnja 1945. godine. To je bio jedan od najvećih tajnih projekata uopće, ali unatoč tome ostao je tajan sve dok nije bombardirana Hirošima. Odnio je 400 000 japanskih života i ostavio trajne posljedice radijacije. Prva atomska bomba testirana je pod tajnim imenom Trojstvo (engl. Trinity). Izrađene su 3 atomske bombe: Trojstvo, Debeljko i Dječak.
Prva atomska bomba Trojstvo je testirana 16. srpnja 1945., blizu mjesta Alamogordo (Novi Meksiko), koristeći plutonij kao nuklearno gorivo. Cijela atomska bomba je bila teška 4 tone, iako je u jezgri bilo samo 6,2 kg plutonija. Energija koju je oslobodila atomska bomba Trojstvo je bila jednaka kao energija eksplozije 20 000 tona TNT.
Jednaku konstrukciju je imala atomska bomba Debeljko (engl. Fat Man), koja je bačena na Nagasaki 9. kolovoza 1945., ubivši 70 000 ljudi i ranivši oko 100 000 ljudi. Treća atomska bomba Dječak (engl. Little Boy) je bila drukčije konstrukcije, gorivo je bio uranij-235, a bačena je na Hirošimu tri dana prije.
Hladni rat
Ogromne količine plutonija su proizvedene u Sovjetskom Savezu i SAD. Samo nuklearni reaktor Hanford je proizveo 103 tone, dok je Sovjetski Savez proizveo oko 170 tona. Danas se proizvede svake godine oko 20 tona za potrebe nuklearnih elektrana. Danas se smatra da ima oko 500 tona plutonija na zalihama, i to pola za nuklearno oružje i pola za nuklearne elektrane.[13]
Medicinski pokusi
Za vrijeme i nakon Drugog svjetskog rata, znanstvenici s projekta Manhattan i ostali, su proučavali utjecaj plutonija na životinje i ljude. Proučavanje na životinjama je pokazalo da je samo nekoliko miligrama plutonija smrtonosna doza. Pokusi su vršeni i na ljudima (18 pokusa) i pokazalo se da je plutonij, koji se nataloži u kostima opasniji od radija.[14]
Primjena
Nuklearno oružje
Plutonij-239 je glavni sastojak nuklearnog oružja, zbog mogućnosti stvaranja nuklearne fisije i dostupnosti. Kritična masa za atomsku bombu je oko 10 kg, a to je oko trećine potrebne kritične mase za uranij-235.
Nuklearno gorivo
Zbog promjene kristalne strukture na dosta niskim temperaturama metalni plutonij ne upotrebljava se kao nuklearno gorivo, već njegove legure ili oksidi. Obično se upotrebljava sinterirana smjesa uranijeva i plutonijeva dioksida. Zbog emisije jakog alfa-zračenja, u plutoniju se stalno stvara toplinska energija.
Izvor električne struje i topline
Plutonij-238 u obliku dioksida i pogodno oblikovan, izvor je toplinske energije koja se može koristiti izravno (primjerice u zaštiti unutrašnjosti svemirskih sondi i rovera od pada temperature), ili umetanjem u radioizotopni termoelektrični generator kao dugotrajan i stabilan izvor električne energije.
Radiološka opasnost
Plutonij se uobičajeno nikad ne nalazi izvan laboratorija ili nuklearne industrije. Glavna opasnost of plutonija je radiotoksičnost. Sam po sebi, izvan tijela, nije previše opasan jer je glavnina zraka koje isijava alfa-zračenje koje zaustavlja i tanki list papira. Dovoljna predostrožnost prilikom rukovanja njegovim elementarnim oblikom je korištenje inertne atmosfere, da ne dođe do oksidacije i rasipanja, te gumenih rukavica, za sprječavanje tjelesne kontaminacije.
Rukovanje plutonijevim spojevima ovisi o njihovim fizikalnim i kemijskim svojstvima, te može biti manje ili više opasno.
Ulaskom plutonija u tijelo, brzo se prevodi u ione kao i svaki drugi reaktivni metal u doticaju s vlagom. Mali dio koji se ne izbaci sustavom za izlučivanje akumulira se u koštanoj srži gdje djeluje tipično radiotoksično - intenzivnim alfa-zračenjem dovodi do radiolize vode u stanicama, stvarajući vrlo energične slobodne radikale koji uništavaju proteinsku aparaturu stanice i DNA. Ovisno o raznim faktorima, to može dovesti i do nekih vrsta raka.
Elementarni plutonij, kao i svi ostali aktinoidi, podložan je neprekidnoj oksidaciji na zraku, tijekom koje povećava svoj obujam i do 70%, čime može razbiti spremnik u kojem se nalazi. U fino razdijeljenom stanju je samozapaljiv na zraku.
Izvori
- ↑ 1,0 1,1 1,2 Sebastian Blumentritt Periodensystem der Elemente, 6. izd., Blume-Verlag, Münster (Savezna Republika Njemačka), 2012., ISBN 978-3-942-53009-5, str. 1
- ↑ [1] "Nuklearni gorivni ciklus"
- ↑ [2] "Plutonij, Pu", Periodni sustav elemenata, 2011.
- ↑ [3] NIH contributors, publisher = U.S. National Library of Medicine, National Institutes of Health, "Plutonium, Radioactive", 2008.
- ↑ "Nitric acid processing" [4] journal = Actinide Research Quarterly, ARQ staff, 2008., publisher = Los Alamos National Laboratory, 2010.
- ↑ [5] "Plutonium: A Wartime Nightmare but a Metallurgist's Dream" Baker Richard D., Hecker, Siegfried S.; Harbur, Delbert R., journal = Los Alamos Science, 1983., publisher = Los Alamos National Laboratory, 2009.
- ↑ [6] "Plutonium is also a superconductor", publisher=PhysicsWeb.org, Dumé Belle, 2002.
- ↑ [7] "Fissile Material", work = Radiation Glossary, publisher = United States Environmental Protection Agency, 2008.,EPA contributors
- ↑ [8] NNDC contributors, Alejandro A. Sonzogni, "Chart of Nuclides", publisher = National Nuclear Data Center, Brookhaven National Laboratory, 2008.
- ↑ [9] "Can Reactor Grade Plutonium Produce Nuclear Fission Weapons?", 2001., publisher=Council for Nuclear Fuel Cycle Institute for Energy Economics, Japan
- ↑ [10] "Nuclear forensic analysis", Moody Kenton James; Hutcheon Ian D.; Grant Patrick M., publisher=CRC Press, 2005.
- ↑ "The plutonium story" Glenn T. Seaborg, publisher=Lawrence Berkeley Laboratory, University of California, [11]
- ↑ "SIPRI Yearbook 2007: Armaments, Disarmament, and International Security", Stockholm International Peace Research Institute, publisher=Oxford University Press, 2007., [12]
- ↑ journal = Los Alamos Science: "The Human Plutonium Injection Experiments", [13], 2006., William Moss, Eckhardt Roger, publisher = Los Alamos National Laboratory
| H | He | ||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | As | Br | Kr | ||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Te | I | Xe | |||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Rn | ||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Alkalijski metali | Zemnoalkalijski metali | Lantanoidi | Aktinoidi | Prijelazni metali | Slabi metali | Polumetali | Nemetali | Halogeni elementi | Plemeniti plinovi |
Datoteka:P chemistry.svg
Nedovršeni članak Plutonij koji govori o kemijskom elementu treba dopuniti. Dopunite ga prema pravilima uređivanja Hrvatske internetske enciklopedije.
![{\displaystyle \mathrm {^{238}_{\ 92}U\ +\ _{0}^{1}n\ \longrightarrow \ _{\ 92}^{239}U\ {\xrightarrow[{23,5\ minuta}]{\beta ^{-}}}\ _{\ 93}^{239}Np\ {\xrightarrow[{2,3565\ dana}]{\beta ^{-}}}\ _{\ 94}^{239}Pu} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/e0abe5eb95ec66811851d79e99bc1924c2756c58)
![{\displaystyle \mathrm {^{238}_{\ 92}U\ +\ _{1}^{2}D\ \longrightarrow \ _{\ 93}^{238}Np\ +\ 2\ _{0}^{1}n\quad ;\quad _{\ 93}^{238}Np\ {\xrightarrow[{2,117\ dana}]{\beta ^{-}}}\ _{\ 94}^{238}Pu} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/4deff38c2dd16fbfe4a27a74f84df53b93878a4f)