Luminiscencija













Luminiscencija (engl. luminescence: svijetljenje, svjetlucanje) je emisija elektromagnetskoga zračenja (pretežito svjetlosti, ali i ultraljubičastog i infracrvenoga zračenja) koje nije pobuđeno toplinskim (termičkim) procesom i povišenom temperaturom tvari, nego je posljedica primanja energije u nekom drugom obliku. Po tome se razlikuje više oblika luminiscencije: bioluminiscencija, elektroluminiscencija, radioluminiscencija (posljedica djelovanja ionizirajućega zračenja), triboluminiscencija (nastaje prilikom lomljenja nekih kristala), luminiscencija trenja, kemijska luminiscencija ili kemiluminiscencija (nastaje u vezi s kemijskim promjenama u nekim tvarima), kristaloluminiscencija (nastupa kod kristalizacije nekih tvari), termoluminiscencija (nastaje zagrijavanjem nekih tvari, ali samo ako su prije toga bile izložene nekomu zračenju, na primjer ionizirajućemu zračenju), fotoluminiscencija (posljedica obasjavanja određenih tvari svjetlošću svih valnih duljina). Tvar luminiscira kada se primanjem energije jednim od navedenih načina elektroni u atomu prvo pobude u više energetsko stanje, a zatim se emisijom dijela ili ukupne primljene energije u obliku zračenja vraćaju u osnovno stanje. Ako se luminiscencija pojavljuje za vrijeme trajanja pobude ili najviše 10–8 sekundi nakon toga, riječ je o fluorescenciji, a opaža li se luminiscencija i pošto pobuda prestane, govori se o fosforescenciji.
Luminiscencija je bila podvrgnuta mnogim pokusima i teoretskim istraživanjima, a tek je kvantna mehanika uspjela riješiti osnovna pitanja u vezi s tom pojavom. Spektar luminiscentnoga zračenja svojstven je za svaku pojedinu tvar, pa se može vrlo uspješno iskoristiti da se odredi prisutnost neke tvari u uzorku. Time se bavi luminiscentna analiza; ona se na primjer upotrebljava i pri određivanju pojedinih vrsta dragoga kamenja. Luminiscencija se primjenjuje u različitim izvorima svjetlosti, najviše za fluorescentnu rasvjetu. Kod te vrste rasvjete primarnu ulogu ima elektroluminiscencija, iako se uz nju rabi i fotoluminiscencija. Ekonomičnija je od obične, toplinske električne rasvjete (električna žarulja), jer je utrošak električne energije za jednaki svjetlosni tok manji, kao i zato što se većina ultraljubičastoga, za oko nevidljivoga zračenja, fotoluminiscentnim procesom pretvara u vidljivi dio spektra. Prikladnim izborom fluorescentne tvari mogu se dobiti sve boje vidljive svjetlosti. U nekim slučajevima, na primjer pri scenskoj rasvjeti, za postizanje specijalnih učinaka (svjetleći zidovi, zavjese i slično) sve se više primjenjuje i fosforescencija. [1]
Objašnjenje
Luminiscencija je zračenje (radijacija) svjetlosnih zraka bez povišenja temperature, a zove se često i hladna svjetlost. Luminiscencija se dijeli na fluorescenciju i fosforescenciju.
Mnoge tvari, na primjer petrolej, barijev platincijanir i druge, same svijetle kad na njih pada svjetlost. Da njihova svjetlost nije obična refleksija (odbijanje), vidi se iz toga što svaka kemijska tvar koja je osvijetljena homogenom svjetlošću svijetli drugom bojom. Tako petrolej, osvijetljen bijelom svjetlošću, svijetli plavičastom svjetlošću, a otopina klorofila u alkoholu, crvenom svjetlošću. Zračenje svjetlosti za vrijeme osvjetljavanja zove se fluorescencija.
Međutim, ima tvari koje nakon osvjetljavanja same svijetle, na primjer fosfor i barijev sulfat. Svijetljenje po prestanku osvjetljavanja zove se fosforescencija.
U svim slučajevima luminiscencije tijelo zrači energiju na račun apsorbirane energije zračenja, pa su valovi koji se emitiraju pri luminiscenciji većinom većih valnih duljina od apsorbiranih valova koji izazivaju luminiscenciju. To se potpuno slaže s kvantnom teorijom svjetlosti, jer tijelo apsorbira kvant svjetlosti (foton) h∙ν pa može emitirati ili tu čitavu energiju ili samo dio te energije, a u tom slučaju mora frekvencija ν biti manja. Nevidljive ultraljubičaste zrake primjećujemo jer izazivaju fluorescenciju nekih tvari s nižom vidljivom frekvencijom. [2]
Povijest
Luminescentne pojave primijećene su u najranijoj povijesti u obliku svjetlećih bakterija u moru, krijesnica, prilikom raspadanja organskih tvari i tako dalje. Te su pojave tisućljećima zbunjivale ljude. Pojava luminescencije ispitivana je još prije Krista u drevnoj Kini i Grčkoj (Aristotel), no prvi je temeljitije ispitivao luminescenciju oko 1603. Vincenzo Cascariolo iz Italije. On je iskustveno (empirijski) sintetizirao anorgansku luminescentnu tvar, nazvanu lapis solaris (sunčani kamen). Kasnije se ustanovilo da je Cascariolo pretvorio žarenjem barijev sulfat u slabo luminiscentni barijev sulfid:
Cascariolo je primijetio da kamen apsorbira svjetlost danju a modro tinja noću. Za Cascariolov kamen bilo je predloženo mnogo imena, između kojih je prevladao naziv kamen fosforus. Taj se naziv od 1640. pripisuje i drugim luminescentnim tvarima.
John Canton (1718. – 1772.), Englez, dobio je 1768. žarenjem školjke kamenice jaču (intenzivniju) luminescenciju od Cascariola. Radi se o reakciji kalcijevog karbonata sa sumporom, što je dalo luminescirajući kalcijev sulfid:
T. Sidat, Francuz, 1886. žario je cinkov oksid u struji vodikovog sulfida (sumporovodik):
i tako dobio tvar koja zeleno luminescira. Tek je A. Kerneuil 1886. dokazao da Cantonova tvar luminescira samo ako su prisutni tragovi bizmuta, a da su tragovi bakra bitni za luminesciranje Sidatove tvari.
Naziv luminescencija prvi je upotrijebio 1888. njemački fizičar E. Wiedemann za sve pojave svijetljenja koje nisu uvjetovane samo porastom temperature. Kasnije se uveo naziv fosfor koji se i danas upotrebljava ne samo za kemijski element, nego često i za krute luminescentne tvari. G. G. Stokes je predložio naziv fluorescencija za luminescenciju kraćeg trajanja od 10-8 sekundi, dok naziv fosforescencija obuhvaća luminescenciju dužeg trajanja. [3]
Vrste luminiscencije
Luminiscencija je pojava emisije svjetlosti koja nije dikretni rezultat žarenja materijala. Može biti izazvana na različite načine, a zapaža se na materijalima koji sadrže ione nečistoće. Većinom je pojava luminiscencije slaba i može se vidjeti samo u mraku. Od Cascariolovog vremena mnoge su kemijske tvari bile podvrgnute različitim postupcima da bi se otkrile nove luminescentne tvari i novi načini pobude. U modernoj se terminologiji upotrebljavaju predmetci (prefiksi) kojima se označuje način pobude pri pojedinim vrstama luminescencije. Poznate vrste luminescencije jesu:
- bioluminiscencija je sposobnost živog bića da samostalno ili uz pomoć simbiota "proizvede" svjetlost;
- elektroluminiscencija je svijetljenje nekih dielektričnih tvari pod utjecajem električne struje (na primjer kada se nalaze u polju izmjenične struje);
- katodoluminescencija je vrsta elektroluminescencije, a nastaje bombardiranjem luminescentne tvari elektronima.
- fluorescencija je vrsta luminiscencije koja je vidljiva samo za trajanja ekspozicije materijala nekom zračenju (na primjer ultraljubičastom, rentgenskom ili katodnom zračenju;
- fosforescencija je luminiscencija koja se nastavlja i nakon prestanka ekspozicije bilo dnevnoj svjetlosti ili svjetlosti svjetiljke;
- fotoluminescencija nastaje zbog pobude tvari svjetlom;
- kemoluminiscencija ili kemijska luminiscencija je izazvana kemijskim reakcijama (na primjer oksidacijom fosfora);
- kristaloluminiscencija nastupa kod kristalizacije nekih kemijskih tvari.
- radioluminiscencija je izazvana ionizirajućim zračenjem; omogućuje nam prepoznavanje i određivanje vrste minerala, strukture njihova raste, područje izmjene u mineralnim fazama te pojava izdvajanja;
- scintilacija je iskričavo svjetlucanje, prouzročeno bombardiranjem luminescentnih kristala alfa česticama, vidljivo tek očima prilagođenim na mrak;
- termoluminiscencija je izazvana zagrijavanjem materijala do temperature ispod crvenog žara; pokazuju je na primjer topaz, dijamant, apatit;
- triboluminiscencija je izazvana drobljenjem, grebanjem ili trljanjem materijala; pretežno se javlja kod minerala nemetala s dobrom kalavošću (na primjer fluorit, glinenci, lepidolit, kalcit).
Osnovne zakonitosti
Fluorescencija je neposredna spontana luminescentna emisija kakvu daje jednostavni izolirani pobuđeni atom. Trajanje fluorescencije za optičke fotone iznosi oko 10-8 sekundi, dok je to trajanje za rendgenske zrake mnogo kraće, pa za zrake valne duljine manje od 0,1 nm iznosi oko 10-16 sekundi. Trajanje luminescencije dulje od 10-8 sekundi može se dobiti pri poludopuštenim radijativnim prijelazima u izoliranom atomu ili sudjelovanjem prikladnih susjednih atoma koji će izmijeniti vrijeme života pobuđenih stanja nekih atoma ili centara u tekućini ili krutini. Takvi su luminescentni materijali fosforescentni.
Luminescencija plinova
Najjednostavnije luminescentne tvari jesu monoatomni plinovi. Nastajanje luminescencije je složeno jer je atom sastavljen od jezgre i jednog do stotinu elektrona, među kojima postoji zamršeno međudjelovanje. Za izolirani atom svojstvena su stacionarna elektronska stanja. Stoga pobuda i emisijski spektar ovisi samo o razlici u energiji elektronskih stanja vanjskih elektrona.
Rezonantna fluorescencija
Rezonantna fluorescencija je fotoluminescencija u kojoj pobudno zračenje odgovara frekvenciji, odnosno valnoj duljini za prijelaz iz osnovnog u pobuđeno stanje, a emisija se zbiva s istom frekvencijom.
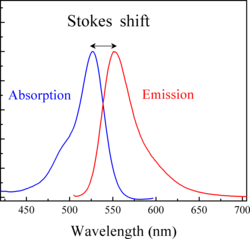
Stokesov pomak
Stokesov pomak se pojavljuje kod emisijskih i apsorpcijskih spektara, gdje je emitirana energija manja od pobudne i emisija se obavlja na većoj valnoj duljini nego fotopobuda, to jest na nižoj frekvenciji.
Luminescencija organskih tvari
Elektronska stanja većine organskih luminescentnih tvari u fazi kapljevine ili fazi krutine (čvrste tvari ili otopine u inertnim otapalima) u dobroj su aproksimaciji (približenju) opisane elektronskim stanjima slobodne molekule u plinskoj fazi. To znači da su međumolekularne sile slabije nego sile unutar molekula. Fotopobuda i spektar luminescentne emisije tih tvari u kondenziranim fazama slični su spektru para. Međumolekularne sile, međutim, dosta su velike pa dovode do proširenja apsorpcijskih i emisijskih linija. U nekim slučajevima dolazi do prijenosa elektronske energije između molekula prije negoli unutar molekule nastanu vibracijske relaksacije, pa se zapaža Stokesov pomak.
Mnoge organske luminescentne tvari jesu aromatske molekule srodne bojilima. Natrijeva sol fluorescira u vodenoj otopini je dobro poznata kao djelotvorna fluorescentna tvar. Druge organske tvari luminesciraju uspješno kada su otopljene u organskim otapalima. Terfenil u ksilenu je tekući β i γ scintilator s emisijom u bliskom ultraljubičastom području. Neke organske molekule luminesciraju najbolje u organskim sredstvima. Primjer je jednopostotni antracen u naftalenu koji je dobar scintilator s emisijom u modrom području. U ovim otopinama energiju apsorbiraju molekule otapala. S otapala energija se prenosi na tvar koja se otapa i koja luminescira.
Neki kristali čistih organskih tvari također luminesciraju. Primjer je kristal benzena.
Fluorescentna emisija i dugovalna apsorpcija organskih tvari često su zrcalno simetrične, a može se objasniti pomoću koordinatnog modela. Za organske molekule koordinata R shematski je prikaz svih intermolekularnih koordinata.
Uz fluorescentnu emisiju, mnoge organske tvari posjeduju fosforescentnu emisiju. Pri fosforescenciji odvija se najprije neradijativna relaksacija s pobuđenog singuletnog stanja na tripletno stanje, a zatim radijativna sa tripletnog stanja na osnovno singuletno stanje.
Helati rijetkih zemalja ispituju se za primjenu u laserima. Pobuda se zbiva u širokom apsorpcijskim vrpcama liganda. Energija se prenosi na ljusku 4f atoma rijetkih zemalja. Luminescentna emisijska linija rijetkih zemalja jest koherentno zračenje velike jakosti (intenziteta). Fluorinantni Eu-acetonat otopljen u acetonitrolu primjer je za tekući laser koji radi na temperaturi blizu sobne.
Luminescencija neorganskih kristala
Luminescencija anorganskih kristala većinom dolazi iz luminescentnih centara, aktivatora, primjesa ugrađenih u kristalnu rešetku ili zbog nesavršenosti kristala.
Primjena luminescencije
Vrlo važno svojstvo jest mogućnost zapažanja emisije pri vrlo malim koncentracijama kemijskih tvari. Često su dovoljne koncentracije reda 10-6 kg/m3. Kako se promatranje obično može ograničiti na obujam reda 10-7 m3, dovoljno je imati 10-13 kg luminescentne tvari da bi emisija bila primjetna. To omogućuje primjene luminescencije u rješavanju niza praktičnih zadataka.
Luminiscentna analiza
Metodama luminiscentne analize razvrstavaju se različite vrste stakla, sortiraju se šljake. Ocjenjuje se poroznost kamenih slojeva i građevinskog materijala tako da se potapaju u fluorescentne otopine. U mnogim kemijskim postupcima, u organskoj, tehničkoj kemiji i biokemiji primjenjuje se luminescencijska analiza za raspoznavanje različitih sastojaka u složenim smjesama. U tekstilnoj se industriji primjenom ove analize otkrivaju inače neprimjetne masne mrlje na tkaninama. Luminiscentna analiza se upotrebljava i pri određivanju pojedinih vrsta dragoga kamenja.
Luminescentna bojila
Luminescentna bojila su neki luminescentni materijali mogu istodobno djelovati i kao bojila ili pigmenti, i kao luminescentni izvor zračenja.
Luminescencijska rasvjeta
Luminescentne tvari se naveliko primjenjuju u rasvjeti. Tako na primjer u visokotlačnim živinim sijalicama u izboju je glavna emisija na kraćim valnim duljinama, pa se upotrebom optičkih filtara može dobiti samo ultraljubičasto zračenje. Ako se baloni takvih sijalica premažu fluorescentnim premazom koji pod djelovanjem ultraljubičastog zračenja svijetli crveno, poboljša se vidljivi dio spektra sijalice.
Osim već spomenutog luminescentnog premaza za fluorescentne cijevi (3 Ca3(PO4)2∙CaF2∙Sb∙Mn), koji daje približno bijelo svijetlo i koji je neotrovan, upotrebljavaju se još slijedeći: Mg2WO5 sa svjetlomodrom emisijom, (Zn∙Be)2SiO4∙Mn s narančastožutom emisijom, Zn2SiO4∙Mn sa zelenom emisijom, CdSiO3∙Mn s narančastocrvenom emisijom. Svjetiljke prekrivene spojevima kao što je na primjer Ca3(PO4)2∙Tl uz maksimum emisije na 330 nm upotrebljavaju se za umjetno sunčanje.
Luminescentni zasloni
Fluorescentni zaslon katodne cijevi je prozirna površina premazana fluorescentnim tvarima koje svijetle i stvaraju slike ovisno o tome koliko ih je elektrona pogodilo, a broj elektrona koji pada na pojedino mjesto na zaslonu u svakom trenutku ovisi o električnom naponu na upravljačkoj rešetki. Primjenjivao se u osciloskopima, radarima, televizijskim prijamnicima i elektroničkim računalima. [4]
Geološka istraživanja
Fotoluminescencija i katodoluminescencija mnogih minerala olakšava geološko ispitivanje, pri čemu služi prijenosni izvor svjetlosti koji omogućava neposredno proučavanje u sloju. Ispitujući luminescenciju komada rude koja sadrži tragove nafte, postoji mogućnost procjene kvalitete nafte.
Stimulirana luminescencija
Elektroluminiscencija PN spojeva poluvodičkih materijala iskorištava se za dobivanje stimulirane emisije. Posebno je poznat GaAs laser koji emitira lasersko zračenje u infracrvenom području, na 840 nm. Za lasere s bojilom upotrebljavaju se luminescence otopine organskih bojila, na primjer otopina rodamina 6G u etanolu.
Ostale primjene
U kriminalistici, luminescencijska analiza omogućava pronalaženje tragova krvi, te otkrivanje tekstova pisanih nevidljivom tintom. Također se uvodi metoda ispitivanja emitiranog svojstvenog rendgenskog zračenja iz primjesa u tragovima sadržanih u uzorcima. Metode su toliko osjetljive da su moguća i kvantitativna ispitivanja.
U paleontologiji fluorescentni snimci iskopina mnogo su bogatiji detaljima od običnih snimaka.
Novija je primjena luminescencentnih tvari u fotonaponskim ćelijama gdje luminescentni materijal povećava djelotvornost dijelova.
Izvori
- ↑ luminiscencija, [1] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2016.
- ↑ Velimir Kruz: "Tehnička fizika za tehničke škole", "Školska knjiga" Zagreb, 1969.
- ↑ "Tehnička enciklopedija" (Luminiscencija), glavni urednik Hrvoje Požar, Grafički zavod Hrvatske, 1987.
- ↑ zaslon (ekran), [2] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2018.


