Jod
- PREUSMJERI Predložak:Infookvir kemijski element



Jod je kemijski element koji se prvenstveno koristi u prehrani. Koristi se i za proizvodnju octene kiseline i polimera. Kako jod ima visoku atomsku masu, malo je otrovan i lako se veže s organskim tvarima, pa često se koristi u magnetnoj rezonanciji.
Poput drugih halogenih elemenata, jod se uglavnom pojavljuje kao dvoatomna molekula I2. U prirodi je jod rijedak element i po raširenosti je 47. To je najteži kemijski element koji se pojavljuje u biološkim organizmima (samo se volfram, kao teži element, može naći kod nekih bakterija). Njegova rijetkost u tlu, vodi do nedostatka joda u mnogim živim organizmima, pa i kod ljudi, tako da nedostatak joda ugrožava oko 2 milijarde ljudi u svijetu i glavni je uzrok pojave mentalne retardacije.[1] Jod je potreban za normalan rad štitne žlijezde. Radioaktivni izotopi joda se također mogu taložiti u štitnoj žlijezdi, pa se izotop jod-131 smatra jednim od najkancerogenijih elemenata koji nastaje u radioaktivnom otpadu, nakon nuklearne fisije, pogotovo zato što snažno emitira beta-čestice.
Fizičko kemijska svojstva[uredi | uredi kôd]
Kristali su sivkastocrne do ljubičaste boje metalnog sjaja. Može se primijetiti snažna sublimacija na sobnim temperaturama u ljubičasto-ružičasti plin snažnog nadražujućeg mirisa. Vrlo je reaktivan s drugim kemijskim elementima, ali manje od drugih halogenih elemenata.
Elementarni jod se lako otapa u organskim otapalima, kao što je heksan ili kloroform, zato što nema polarnosti, ali se u vodi slabo otapa. Ipak, otapanje joda u vodi se može povećati dodavanjem kalijevog jodida. Molekularni jod I2 reagira s negativnim ionom, stvarajući anion trijodid I3− u ravnoteži, koji je topiv u vodi. Na taj način se u medicini koristi antiseptička jodna tinktura, jako dezinfekcijsko sredstvo koje ubija bakterije i gljivice.
Boja otopine elementarnog joda se mijenja ovisno o polarnosti otapala. U nepolarnim otapalima kao što je heksan, otopina je ljubičasta; u osrednje polarnom diklormetanu otopina je tamno crvena, a u jako polarnim otapalima, kao što je aceton ili etanol otopina je narančasta ili smeđa. Talište joda je na relativno niskoj temperaturi od 113,7 °C, iako je tekućina često zamagljena s gustom ljubičastom parom joda.
Nalazišta[uredi | uredi kôd]
Jod je rijedak u Sunčevom sustavu i u Zemljinoj kori (po raširenosti je 47), ali su jodne soli često vrlo topive u vodi. Jod se pojavljuje u nešto većoj koncentraciji u morskoj vodi, nego u stijenama. Salitra sadrži jod u sebi i ima je najviše u Čileu. Smeđe alge sadrže isto joda u sebi, najčešće u obliku metilnog jodida, pa se jod može dobiti i iz pepela morskih algi. Jod se u prirodi nalazi uglavnom u obliku jodida i jodata. Od nekoliko mjesta u svijetu gdje se može pronaći joda, samo su dva izvora komercijalno isplativa: salitra u Čileu i nalazišta slane vode u Japanu (Minami Kanto) i SAD (Anadarko polje).[2]
Izotopi[uredi | uredi kôd]
Od 37 poznatih izotopa joda, samo je jod-127 stabilan.
Najdugotrajniji izotop je jod-129, koji ima vrijeme poluraspada 15,7 milijuna godina. Ipak, o njegovom prisustvu u nastanku Sunčevog sustava, doznajemo preko njegove “sestre” – ksenona-129. Danas, on nastaje pod utjecajem kozmičkih zraka i kao ostatak nuklearnih pokusa, što ga čini jednim od najdugotrajnijih zagađivača ljudskog okoliša.
Dugotrajan izotop je i jod-125, koji ima vrijeme poluraspada 59 dana. Koristi se kao uobičajeni stvaralac gama zračenja za biološka ispitivanja bjelančevina i za medicinske snimke. Koristi se i za brahiterapiju, a to je postupak koji uključuje postavljanje radioaktivnih izvora unutar tijela. Brahiterapija je jedna vrsta terapije zračenjem koja se koristi za liječenje raka. Brahiterapija se ponekad naziva i unutarnje zračenje.
Jod-123 ima vrijeme poluraspada 13 sati i isto se koristi za medicinsku radiologiju, posebno za snimanje žlijezde štitnjače, koja prirodno upija izotope joda.
Jod-131 ima vrijeme poluraspada 8 dana i stvara beta-čestice. Nastaje uglavnom kod nuklearne fisije. Isto se koristi kao terapija zračenjem za liječenje raka. Posebno se koristi za liječenje Gravesove (Basedowljeve) bolesti. U liječenju Gravesove hipertireoze primjenjuju se više od 60 godina terapija joda-131. Kalijev jodid (tablete) može smanjiti rizik od raka štitnjače kod izloženosti radioaktivnom jodu-131.
Povijest[uredi | uredi kôd]
Ime jod mu dolazi od grčke riječi ioeides za ljubičastu boju zbog karakteristične boje njegovih para. To je sjajna, ljubičasto-crna krutina karakterističnog mirisa koja lako sublimira. Jod se slabo otapa u vodi, ali se dobro otapa u alkoholu i u koncentriranoj vodenoj otopini kalijevog jodida (Lugolova otopina) te u eteru i kloroformu. Pare joda su otrovne. Jod izaziva opekline na koži.
Jod je 1811. godine otkrio Bernard Courtois (Francuska). Njegov otac je bio proizvodač kalijevog nitrata, koji je jedan od glavnih sastojaka za dobivanje baruta. Za vrijeme vladavine Napoleona Bonaparte, bila je velika potražnja za kalijevim nitratom. U proizvodnji se koristio i natrijev karbonat, koji se dobivao sušenjem morskih trava iz Normandije i Bretanje. Morska trava bi se zapalila, a njen pepeo se prao vodom, a zatim tretirao sa sumpornom kiselinom. Jednog dana je Courtois dodao malo previše sumporne kiseline, pa se pojavila gusta ljubičasta para. Zabilježio je da bi se para kristalizirala na hladnim površinama, stvarajući tamne kristale. Pretpostavio je da se radi o nekom novog elementu, ali nije imao dovoljno novčanih sredstava da nastavi s istraživanjem.[3][4]
Courtois je uzorke kristala poklonio Josephu Gay-Lussacu , André-Marie Ampèreu i drugim francuskim znanstvenicima toga doba. Uzorci su stigli i do Humphry Davya, koji je primijetio da je novi element po svojstvima sličan kloru.
Opasnosti[uredi | uredi kôd]
- nadražljivac donjih dišnih puteva
- bol u grlu, glavobolja, težina u prsima, pri višim koncentracijama otežano disanje
- plućni edem
- kristalni jod - teške ozljede oka - ispiranje vodom do 1 sat
- gutanje - oštećenje bubrega - smrt
Primjena[uredi | uredi kôd]
Koristi se u organskoj i farmaceutskoj industriji, a u medicini kao antiseptik.
Katalizator[uredi | uredi kôd]
Glavna primjena joda je kao jedan od katalizatora za dobivanje octene kiseline.
Dezinfekcija vode[uredi | uredi kôd]
Od halogenih elemenata (F, Cl, Br, I i At) za dezinfekciju široku upotrebu imaju klor i jod (Cl i I).
Jod u prehrani[uredi | uredi kôd]
Kuhinjska sol se jodira, što znači da se dodaje mala količina joda. Jod je potreban za proizvodnju hormona štitnjače, a nedostatak joda može usporiti razvoj i rast. Korištenje jodirane soli je važno u područjima gdje su prirodne razine joda u tlu niske i gdje povrće ne prima jod iz tla. Morska sol ne sadrži jod.
U Hrvatskoj se već više od četrdeset godina provodi jodiranje soli u svrhu očuvanja mentalnog zdravlja dojenčadi i sprječavanja pojave gušavosti u odraslih. Britanski University od Dundee na temelju istraživanja utvrdio da 40 % žena u drugom stanju ne unosi niti polovicu potrebnog joda u organizam. Također je objavljeno da su istraživači u Španjolskoj kao i u Italiji utvrdili manji stupanj inteligencije kod školske djece čija prehrana ne sadrže dovoljno joda. Stanje u Hrvatskoj je u tom pogledu mnogo bolje. Ipak malo čudi da je takav problem mogao biti uopće prisutan u zakonodavno i zdravstveno uređenim zemljama Europske unije.[5]
Dostupan bez recepta, kalijev jodid zaustavlja nakupljanje radioaktivnog joda-131 u štitnjači, gdje on može izazvati rak. Nakon Černobilske nesreće 1986., zabilježene su tisuće slučajeva raka štitnjače, prije svega među onima koji su u vrijeme te nuklearne katastrofe bili djeca i pili mlijeko kontaminiranih krava.[6]
Medicinska radiologija[uredi | uredi kôd]
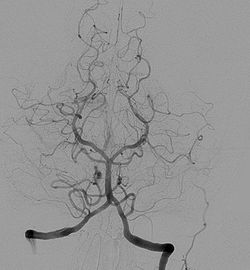
Jod kao teški element je pogodan za radiloško snimanje, jer radi sjene (kontrast) na snimkama kod računalne tomografije i angiografije. Angiološki pregledi predstavljaju kontrastne invazivne dijagnostičke radiološke metode pregleda srca i krvnih žila. Indikacije za te preglede predstavljaju bolesti krvožilnog sustava, centralnog živčanog sustava, sredoprsja i pluća, trbušnih organa i urogenitalnih organa. Oni su postali nezamjenjive u dijagnostici kongenitalnih vaskularnih malformacija, ateromatoze, tromboze i embolije te u dijagnostici tumora i oboljenja parenhimnih organa. Može se reći da je arteriografija znatno pridonijela napretku medicine uopće. Kontraindikacije za tu vrstu dijagnostike jesu opće loše stanje pacijenta, produženo vrijeme krvarenja, smanjen broj trombocita, kao i dokazana alergija na jod, koji je sastavni dio kontrastnog sredstva.
Kromatografija[uredi | uredi kôd]
Tvari koje se nalaze u prirodi, kao i produkti sinteza, najčešće se javljaju u kompleksnim smjesama. Klasične metode odjeljivanja (kristalizacija, sublimacija, ekstrakcija, destilacija) samo donekle mogu riješiti problem odjeljivanja individualnih komponenti iz smjese. Većina smjesa organskih spojeva je složena zbog velikog broja spojeva koji često imaju slična fizikalnokemijska svojstva. Mnogi od njih imaju slične ili čak iste molekulske formule, te mogu biti konstitutivni izomeri i stereomeri. Zbog navedenog, odjeljivanje komponenti iz smjese može predstavljati ozbiljan problem. Razdvajanje antibiotika, vitamina, hormona, polipeptida, terpena, alkaloida i drugih srodnih spojeva riješeno je uporabom kromatografije. Jod je uobičajena tvar za tankoslojnu kromatografiju.[7]
Biološka uloga joda[uredi | uredi kôd]
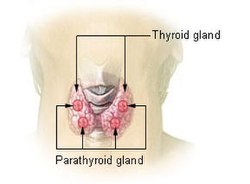
Štitna žlijezda je smještena u području vrata, s prednje strane dušnika, neposredno ispod Adamove jabučice, stvara hormone koji u svom sastavu imaju jod, a uvelike kontroliraju metabolizam našeg organizma. Jednostavnije rečeno, hormoni štitnjače kontroliraju brzinu kojom će se zbivati izmjena tvari u našem organizmu, koliko brzo će se tvari uz prisustvo kisika razgraditi, a novonastale strukture ugraditi u stanicu. Jod je neophodan element za normalan rad ove male žlijezde, te svaki nedostatak joda u organizmu vrlo brzo dovodi do nastanka jedne od najraširenijih bolesti „nutritivnog karaktera" - uvećanja štitnjače ili gušavosti.[8]
Namirnice koje su najbogatije jodom jesu: morske ribe, alge, jaja, jogurt, sir, jodirana sol. Pojedine namirnice na neki način brane organizmu pravilno iskorištavanje joda i mogu umanjiti sposobnost organizma da iskoristi jod za sintezu hormona štitnjače. Dobro je znati da u te namirnice ubrajamo: cvjetača, kelj, prokulice, repa i kikiriki. Najviše su riziku izloženi strogi vegetarijanci (veganisti) koji takve namirnice svakodnevno koriste u prehrani i to u velikim količinama. U zemljama u razvoju gušavost je vrlo često posljedica jedne autoimune bolesti koja smanjuje funkciju štitnjače, pa nastupa hipotireoza.
Izvori[uredi | uredi kôd]
- ↑ [1] "In Raising the World’s I.Q., the Secret’s in the Salt" McNeil Donald G. Jr, 2006., New York Times
- ↑ "Methyl iodide: Atmospheric budget and use as a tracer of marine convection in global models" Bell N., journal = Journal of Geophysical Research, 2002.
- ↑ Courtois Bernard: "Découverte d'une substance nouvelle dans le Vareck", journal=Annales de chimie, 1813., [2]
- ↑ Swain Patricia A.: "Bernard Courtois (1777–1838) famed for discovering iodine (1811), and his life in Paris from 1798", journal=Bulletin for the History of Chemistry, 2005. [3] (Arhivirano 14. srpnja 2010.)
- ↑ Net.hr: "Zbog ovoga djeca imaju manji kvocijent inteligencije" [4] 2011.
- ↑ Novi list.hr: "Užasnuti Amerikanci mahnito kupuju antiradijacijske pilule" [5] 2011.
- ↑ Igor Jerković i Ani Radonić: "Praktikum iz organske kemije" [6] 2011.
- ↑ Dr. Nives Tarle-Bajić: "Bolesti štitnjače" [7] 2011.
| H | He | ||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | As | Br | Kr | ||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Te | I | Xe | |||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Rn | ||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Alkalijski metali | Zemnoalkalijski metali | Lantanoidi | Aktinoidi | Prijelazni metali | Slabi metali | Polumetali | Nemetali | Halogeni elementi | Plemeniti plinovi |
![]() Nedovršeni članak Jod koji govori o kemijskom elementu treba dopuniti. Dopunite ga prema pravilima uređivanja Hrvatske internetske enciklopedije.
Nedovršeni članak Jod koji govori o kemijskom elementu treba dopuniti. Dopunite ga prema pravilima uređivanja Hrvatske internetske enciklopedije.



