Natrijev karbonat
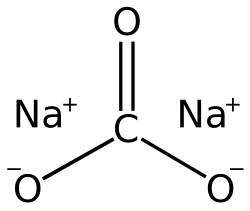
Natrijev karbonat (Na2CO3 x 10H2O, kristalna soda, kalcinirana soda) je bezbojan do bijeli kruti kristal koji se u prirodi nalazi kao mineral soda (Na2CO3 x 10H2O), trona, tennonatrit, gejlisit, personit i hanksit. Lako se otapa u vodi, a otopina natrijeva karbonata djeluje jako lužnata, zbog hidrolize, i nagriza tkiva.
Najvažnije soli ugljične kiseline su natrijev hidrogenkarbonat i natrijev karbonat. Te soli su od izuzetne važnosti u industrijskoj primjeni.
Natrijev karbonat bezvodni (Na2CO3, soda bez vode, soda) je higroskopan, a stajanjem na zraku reagira s CO2 i H2O stvarajući NaHCO3. Neutralizacijom natrijeve lužine ugljikovim(IV) oksidom nastaje natrijev hidrogenkarbonat (NaHCO3) ili natrijev karbonat (NaCO3), ovisno o odnosu množina reaktanata:
Na+(aq) + OH-(aq) + CO2(g) --> NaHCO3(s)
2 Na+(aq) + 2 OH-(aq) + CO2(g) --> 2 Na+(aq) + CO32-(aq) + H2O
Uparavanjem otopine natrijeva karbonata, nastaje bijeli prah, dobro topljiv u vodi. Vodena je otopina zbog hidrolize jako lužnata, pa se vrlo često zbog tog svojstva koristi u industriji kao jeftinija sirovina i zamjena za natrijevu lužinu. Kristalizacijom iz otopine nastaju veliki prozirni kristali - kristalna soda (natrijev karbonat, Na2CO3 x 10 H2O).
Uporaba
Natrijev karbonat je važna sirovina za kemijsku industriju i ima veliku primjenu u industriji stakla, boja, papira, celuloze, industriji umjetne svile, tekstila, deterdženta i prašaka za pranje, sapuna, sredstava za prskanje te za izbjeljivanje i štavljenje kože, za oplemenjivanje vune i pamuka, hidrolizu bjelančevina, dobivanje margarina, odjeljivanje soka iz šećerne repe, rabi se i za omekšivanje vode, te za dobivanje drugih spojeva, itd..
Dobivanje
U prirodi se nalazi u malim količinama čist, pa se proizvodi raznim industrijskim postupcima.
1.
Jedan od načina proizvodnje je tzv. amonijačni Solvayev postupak iz NH3, NaCl i CaCO3; gdje nastaje neutralizacijom natrijeve lužine s ugljikovim(IV) oksidom.
Ovim postupkom uvodi se amonijak u zasićenu otopinu natrijeva klorida, čime otopina postaje lužnata. Amonijakalna otopina natrijeva klorida neutralizira se uvođenjem CO2 (ugljikov(IV) oksid) do zasićenja.
Reakcijom u vodenoj otopini nastaju ioni NH4+, Na+, HCO3- i Cl-, koji bi mogli dati četiri različite soli: amonijev klorid (NH4Cl), amonijev hidrogenkarbonat (NH4HCO3), natrijev klorid (NaCl) i natrijev hidrogenkarbonat (NaHCO3).
Otopina koja sadrži ione Na+, NH4+, Cl- i HCO3- se hladi, pri čemu se taloži najslabije topljiv natrijev hidrogenkarbonat (NaHCO3), a u otopini ostaju amonijevi i kloridni ioni, jer je amonijev klorid najbolje topiv.
2.
Zagrijavanjem natrijeva hidrogenkarbonata, (kalciniranje) dobije se natrijev karbonat.
Oslobođeni CO2 vraća se u proces, a gubitak se nadoknađuje prženjem vapnenca, tj. kalcijeva karbonata:
CaCO3 --> CaO + CO2
Dobiveni CaO (živo vapno) prevodi se u kalcijeva hidroksid (gašeno vapno):
CaO + H2O --> Ca(OH)2
koji se upotrebljava za oslobađanje amonijaka iz amonijeva klorida.
Regenerirani amonijak ponovo se uvodi u zasićenu otopinu natrijeva klorida i čitav proces se ponavlja.
Proces je vrlo ekonomičan jer se upotrebljavaju jeftine sirovine (morska ili kamena sol i vapnenac), a amonijak /najskuplja u tom postupku/ i dio ugljikova dioksida, vraćaju se ponovo u proces (recikliraju se).
Amonijak se regenerira iz otopine amonijeva klorida reakcijom s vapnom (CaO).
3. Iz otopine Na2CO3 se dodatkom Ca(OH)2 pripravlja NaOH.
4. Industrijski se dobiva kalciniranjem kuhinjske soli.
5. Natrijev karbonat se može dobiti reakcijom ugljikovog dioksida i natrijevog hidroksida
- CO2 + 2NaOH --> Na2CO3 + H2O
Daljnjom reakcijom natrijevog karbonata, ugljikovog dioksida i vode nastaje natrijev hidrogenkarbonat (soda bikarbona).[1]
Izvori
- ↑ Hrvatska enciklopedija (LZMK); broj 7 (Mal-Nj), str. 602. Za izdavača: Leksikografski zavod Miroslav Krleža, Zagreb 2005.g. ISBN 953-6036-37-1
![]() Nedovršeni članak Natrijev karbonat koji govori o kemiji treba dopuniti. Dopunite ga prema pravilima uređivanja Hrvatske internetske enciklopedije.
Nedovršeni članak Natrijev karbonat koji govori o kemiji treba dopuniti. Dopunite ga prema pravilima uređivanja Hrvatske internetske enciklopedije.