Standardni elektrodni potencijal
1. platinska pločica koja je prevučena poroznom platinom (elektroplatiranje),
2. struja plinovitog vodika,
3. razrijeđena klorovodična kiselina s aktivitetom ili koncentracijom vodikovog iona H+ = 1 mol dm−3,
4. vodena brtva kola spriječava utjecaj kisika,
5. otopina metalne soli u kojoj se nalazi metal kojem se mjeri standardni elektrodni potencijal, koja je odvojena nekom dijafragmom, koja razdvaja otopine ali propušta ione.
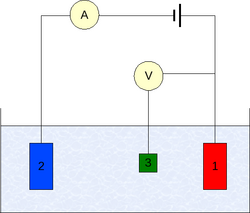
Standardni elektrodni potencijal (E°) određen je mjerenjem relativnih elektrodnih potencijala uz standardne uvjete (aktivitet 1, tlak 101 325 Pa i temperatura 25 °C) prema standardnoj vodikovoj elektrodi.
Elektrodni potencijal je električni potencijal elektrokemijske ćelije u kojoj je ispitivana elektroda spojena kao katoda, a standardna vodikova elektroda (E = 0,000 V) kao anoda. Na katodi se uvijek događa redukcija a na anodi oksidacija. Elektrodni potencijal je po definiciji redukcijski potencijal. Prema IUPAC-ovu dogovoru, izraz elektrodni potencijal namijenjen je isključivo za polureakcije napisane kao redukcije. Predznak elektrodnog potencijala određen je predznakom dotičnog polučlanka spojenog sa standardnom vodikovom elektrodom. Pozitivni predznak upućuje na to da je reakcija spontana u odnosu na standardnu vodikovu elektrodu, to jest da se polučlanak spontano ponaša kao katoda.[1]
Objašnjenje
Zaroni li se metalna elektroda u otopinu elektrolita, na primjer srebrna elektroda u otopinu soli srebra, preći će, jer kemijski potencijal akceptora elektrona (u uzetom primjeru iona srebra Ag+) s obiju strana međufazne granične plohe općenito nije jednak, elektroni s metala (u kojemu su slobodno pokretljivi) kroz graničnu plohu u elektrolit dok se (za vrlo kratko vrijeme, tisućinke sekunde) uspostavi ravnoteža, to jest jednakost kemijskih potencijala. Uslijed toga se poremećuje elektroneutralnost obiju faza, i elektroda i elektrolit dobiju električni naboj. U uzetom primjeru srebrna bi se elektroda nabila pozitivno, a elektrolit negativno; u drugom slučaju, elektroni mogu prijeći s elektrolita na elektrodu, te se faze nabijaju obrnuto nego u uzetom primjeru. U stvari, smatra se da uspostavljena ravnoteža nije statička, nego dinamička, to jest da u oba navedena slučaja elektroni neprestano prolaze kroz graničnu plohu u oba smjera, ali prolaze u jednom smjeru ispočetka brže nego u drugom, dok se u ravnotežnom stanju brzine u oba smjera ne izjednače:
- Ag - e– ⇆ Ag+
Uslijed razdvajanja naboja nastaje na granici faza skok potencijala.
Izravno se, pokusom (eksperimentom), skok potencijala u međufaznom području na jednoj elektrodi ne može odrediti. Mjerenje razlike potencijala između dvije točke zahtijeva da mjerni instrument bude s te dvije točke vodljivo spojen; u ovom slučaju to znači da instrument mora nužno biti spojen s dvije elektrode: onom na kojoj se želi mjeriti skok potencijala i drugom, zaronjenom u elektrolit na mjestu prema kojemu se razlika potencijala želi mjeriti; mjerni će instrument pokazivati zbroj razlika potencijala na svim granicama faza u tako uspostavljenom električnom krugu. Drugim riječima: može se mjeriti samo razlika među potencijalima elektroda elektrokemijskog sustava (na primjer elektromotorna sila galvanskog članka - elektromotornom silom galvanskog članka naziva se razlika između potencijala njegovih elektroda u ravnotežnom stanju, kada ne teče električna struja), a ne pad potencijala na pojedinim elektrodama.
Zahvaljujući činjenici da postoje elektrode s međufaznim područjem kroz koje je skok potencijala na određenoj temperaturi gotovo konstantan bez obzira na to u kakav su elektrolit zaronjene, može se ustanoviti skala relativnih potencijala u odnosu prema jednoj takvoj elektrodi, koja se naziva standardnom ili referentnom elektrodom. Elektroda čiji je potencijal na 25 °C uzet kao nula skale relativnih potencijala je standardna vodikova elektroda. Nju sačinjava platinska pločica koja je prevučena poroznom platinom (elektroplatiranje), zasićenom plinovitim vodikom pod tlakom 1 atm (101 325 Pa), i zaronjena u otopinu koja sadrži vodikove ione u koncentraciji 1 mol/l.
Popis standardnih elektrodnih potencijala
Objašnjenje: (s) - krutina; (l) - tekućina; (g) - plin; (aq) - razvodnjen; (Hg) - amalgam.
| Polureakcije (redukcije) | E° (V) | Ref. | ||
|---|---|---|---|---|
| Oksidans | ⇆ | Reducens | ||
| Sr+ + e- | ⇆ | Sr | -4,10 | [2] |
| Ca+ + e- | ⇆ | Ca | -3,8 | [2] |
| Pr3+ + e- | ⇆ | Pr2+ | -3,1 | [2] |
| 3N2(g) + 2 H+ + 2 e- | ⇆ | 2 HN3(aq) | -3,09 | [3][4] |
| Li+ + e- | ⇆ | Li(s) | -3,0401 | [5][6] |
| N2(g) + 4H2O + 2 e- | ⇆ | 2 NH2OH(aq) + 2 OH- | -3,04 | [4] |
| Cs+ + e- | ⇆ | Cs(s) | -3,026 | [5] |
| Ca(OH)2 + 2 e- | ⇆ | Ca + 2 OH− | -3,02 | [7] |
| Er3+ + e- | ⇆ | Er2+ | -3,0 | [7] |
| Ba(OH)2 + 2 e- | ⇆ | Ba + 2 OH− | -2,99 | [7] |
| Rb+ + e- | ⇆ | Rb(s) | -2,98 | [5] |
| K+ + e- | ⇆ | K(s) | -2,931 | [5] |
| Ba2+ + 2 e- | ⇆ | Ba(s) | -2,912 | [5] |
| La(OH)3(s) + 3 e- | ⇆ | La(s) + 3 OH- | -2,90 | [5] |
| Fr+ + e- | ⇆ | Fr | -2,9 | [7] |
| Sr2+ + 2 e- | ⇆ | Sr(s) | -2,899 | [5] |
| Sr(OH)2 + 2 e- | ⇆ | Sr + 2 OH− | -2,88 | [7] |
| Ca2+ + 2 e- | ⇆ | Ca(s) | -2,868 | [5] |
| Eu2+ + 2 e- | ⇆ | Eu(s) | -2,812 | [5] |
| Ra2+ + 2 e- | ⇆ | Ra(s) | -2,8 | [5] |
| Ho3+ + e- | ⇆ | Ho2+ | -2,8 | [7] |
| Bk3+ + e- | ⇆ | Bk2+ | -2,8 | [7] |
| Yb2+ + 2 e- | ⇆ | Yb | -2,76 | [7] |
| Na+ + e- | ⇆ | Na(s) | -2,71 | [5][8] |
| Mg+ + e- | ⇆ | Mg | -2,70 | [7] |
| Nd3+ + e- | ⇆ | Nd2+ | -2,7 | [7] |
| Mg(OH)2 + 2 e- | ⇆ | Mg + 2 OH− | -2,690 | [7] |
| Sm2+ + 2 e- | ⇆ | Sm | -2,68 | [7] |
| Be2O32− + 3 H2O + 4 e- | ⇆ | 2 Be + 6 OH− | -2,63 | [7] |
| Pm3+ + e- | ⇆ | Pm2+ | -2,6 | [7] |
| Dy3+ + e- | ⇆ | Dy2+ | -2,6 | [7] |
| No2+ + 2 e- | ⇆ | No | -2,50 | [7] |
| HfO(OH)2 + H2O + 4 e- | ⇆ | Hf + 4 OH− | -2,50 | [7] |
| Th(OH)4 + 4 e- | ⇆ | Th + 4 OH− | -2,48 | [7] |
| Md2+ + 2 e- | ⇆ | Md | -2,40 | [7] |
| Tm2+ + 2 e- | ⇆ | Tm | -2,4 | [7] |
| La3+ + 3 e- | ⇆ | La(s) | -2,379 | [5] |
| Y3+ + 3 e- | ⇆ | Y(s) | -2,372 | [5] |
| Mg2+ + 2 e- | ⇆ | Mg(s) | -2,372 | [5] |
| ZrO(OH)2(s) + H2O + 4 e- | ⇆ | Zr(s) + 4 OH- | -2,36 | [5] |
| Pr3+ + 3 e- | ⇆ | Pr | -2,353 | [7] |
| Ce3+ + 3 e- | ⇆ | Ce | -2,336 | [7] |
| Er3+ + 3 e- | ⇆ | Er | -2,331 | [7] |
| Ho3+ + 3 e- | ⇆ | Ho | -2,33 | [7] |
| H2AlO3− + H2O + 3 e- | ⇆ | Al + 4 OH− | -2,33 | [7] |
| Nd3+ + 3 e- | ⇆ | Nd | -2,323 | [7] |
| Tm3+ + 3 e- | ⇆ | Tm | -2,319 | [7] |
| Al(OH)3(s) + 3 e- | ⇆ | Al(s) + 3 OH- | -2,31 | |
| Sm3+ + 3 e- | ⇆ | Sm | -2,304 | [7] |
| Fm2+ + 2 e- | ⇆ | Fm | -2,30 | [7] |
| Am3+ + e- | ⇆ | Am2+ | -2,3 | [7] |
| Dy3+ + 3 e- | ⇆ | Dy | -2,295 | [7] |
| Lu3+ + 3 e- | ⇆ | Lu | -2,28 | [7] |
| Tb3+ + 3 e- | ⇆ | Tb | -2,28 | [7] |
| Gd3+ + 3 e- | ⇆ | Gd | -2,279 | [7] |
| H2 + 2 e- | ⇆ | 2 H− | -2,23 | [7] |
| Es2+ + 2 e- | ⇆ | Es | -2,23 | [7] |
| Pm2+ + 2 e- | ⇆ | Pm | -2,2 | [7] |
| Tm3+ + e- | ⇆ | Tm2+ | -2,2 | [7] |
| Dy2+ + 2 e- | ⇆ | Dy | -2,2 | [7] |
| Ac3+ + 3 e- | ⇆ | Ac | -2,20 | [7] |
| Yb3+ + 3 e- | ⇆ | Yb | -2,19 | [7] |
| Cf2+ + 2 e- | ⇆ | Cf | -2,12 | [7] |
| Nd2+ + 2 e- | ⇆ | Nd | -2,1 | [7] |
| Ho2+ + 2 e- | ⇆ | Ho | -2,1 | [7] |
| Sc3+ + 3 e- | ⇆ | Sc(s) | -2,077 | [9] |
| AlF63− + 3 e- | ⇆ | Al + 6 F− | -2,069 | [7] |
| Am3+ + 3 e- | ⇆ | Am | -2,048 | [7] |
| Cm3+ + 3 e- | ⇆ | Cm | -2,04 | [7] |
| Pu3+ + 3 e- | ⇆ | Pu | -2,031 | [7] |
| Pr2+ + 2 e- | ⇆ | Pr | -2,0 | [7] |
| Er2+ + 2 e- | ⇆ | Er | -2,0 | [7] |
| Eu3+ + 3 e- | ⇆ | Eu | -1,991 | [7] |
| Lr3+ + 3 e- | ⇆ | Lr | -1,96 | [7] |
| Cf3+ + 3 e- | ⇆ | Cf | -1,94 | [7] |
| Es3+ + 3 e- | ⇆ | Es | -1,91 | [7] |
| Pa4+ + e- | ⇆ | Pa3+ | -1,9 | [7] |
| Am2+ + 2 e- | ⇆ | Am | -1,9 | [7] |
| Th4+ + 4 e- | ⇆ | Th | -1,899 | [7] |
| Fm3+ + 3 e- | ⇆ | Fm | -1,89 | [7] |
| Np3+ + 3 e- | ⇆ | Np | -1,856 | [7] |
| Be2+ + 2 e- | ⇆ | Be | -1,847 | [7] |
| H2PO2− + e- | ⇆ | P + 2 OH− | -1,82 | [7] |
| U3+ + 3 e- | ⇆ | U | -1,798 | [7] |
| Sr2+ + 2 e- | ⇆ | Sr/Hg | -1,793 | [7] |
| H2BO3− + H2O + 3 e- | ⇆ | B + 4 OH− | -1,79 | [7] |
| ThO2 + 4H+ + 4 e- | ⇆ | Th + 2 H2O | -1,789 | [7] |
| HfO2+ + 2 H+ + 4 e- | ⇆ | Hf + H2O | -1,724 | [7] |
| HPO32− + 2 H2O + 3 e- | ⇆ | P + 5 OH− | -1,71 | [7] |
| SiO32− + H2O + 4 e- | ⇆ | Si + 6 OH− | -1,697 | [7] |
| Al3+ + 3 e- | ⇆ | Al(s) | -1,662 | [7] |
| Ti2+ + 2 e- | ⇆ | Ti(s) | -1,63 | [8] |
| ZrO2(s) + 4 H+ + 4 e- | ⇆ | Zr(s) + 2 H2O | -1,553 | [3] |
| Zr4+ + 4 e- | ⇆ | Zr(s) | -1,45 | [3] |
| Ti3+ + 3 e- | ⇆ | Ti(s) | -1,37 | [10] |
| TiO(s) + 2 H+ + 2 e- | ⇆ | Ti(s) + H2O | -1,31 | |
| Ti2O3(s) + 2 H+ + 2 e- | ⇆ | 2 TiO(s) + H2O | -1,23 | |
| Zn(OH)42− + 2 e- | ⇆ | Zn(s) + 4 OH- | -1,199 | [3] |
| Mn2+ + 2 e- | ⇆ | Mn(s) | -1,185 | [3] |
| Fe(CN)64− + 6 H+ + 2 e- | ⇆ | Fe(s) + 6HCN(aq) | -1,16 | [11] |
| Te(s) + 2 e- | ⇆ | Te2− | -1,143 | [2] |
| V2+ + 2 e- | ⇆ | V(s) | -1,13 | [2] |
| Nb3+ + 3 e- | ⇆ | Nb(s) | -1,099 | |
| Sn(s) + 4 H+ + 4 e- | ⇆ | SnH4(g) | -1,07 | |
| SiO2(s) + 4 H+ + 4 e- | ⇆ | Si(s) + 2 H2O | -0,91 | |
| B(OH)3(aq) + 3 H+ + 3 e- | ⇆ | B(s) + 3 H2O | -0,89 | |
| Fe(OH)2(s) + 2 e- | ⇆ | Fe(s) + 2 OH- | -0,89 | [11] |
| Fe2O3(s) + 3 H2O + 2 e- | ⇆ | 2Fe(OH)2(s) + 2 OH- | -0,86 | [11] |
| TiO2+ + 2 H+ + 4 e- | ⇆ | Ti(s) + H2O | -0,86 | |
| 2 H2O + 2 e- | ⇆ | H2(g) + 2 OH- | -0,8277 | [3] |
| Bi(s) + 3 H+ + 3 e- | ⇆ | BiH3 | -0,8 | [3] |
| Zn2+ + 2 e- | ⇆ | Zn(Hg) | -0,7628 | [3] |
| Zn2+ + 2 e- | ⇆ | Zn(s) | -0,7618 | [3] |
| Ta2O5(s) + 10 H+ + 10 e- | ⇆ | 2}Ta(s) + 5 H2O | -0,75 | |
| Cr3+ + 3 e- | ⇆ | Cr(s) | -0,74 | |
| [Au(CN)2]− + e- | ⇆ | Au(s) + 2 CN− | -0,60 | |
| Ta3+ + 3 e- | ⇆ | Ta(s) | -0,6 | |
| PbO(s) + H2O + 2 e- | ⇆ | Pb(s) + 2 OH- | -0,58 | |
| 2 TiO2(s) + 2 H+ + 2 e- | ⇆ | Ti2O3(s) + H2O | -0,56 | |
| Ga3+ + 3 e- | ⇆ | Ga(s) | -0,53 | |
| U4+ + e- | ⇆ | U3+ | -0,52 | [12] |
| H3PO2(aq) + H+ + e- | ⇆ | P(bijeli) + 2 H2O | -0,508 | [3] |
| H3PO3(aq) + 2 H+ + 2 e- | ⇆ | H3PO2(aq) + H2O | -0,499 | [3] |
| H3PO3(aq) + 3 H+ + 3 e- | ⇆ | P(crveni) + 3 H2O | -0,454 | [3] |
| Fe2+ + 2 e- | ⇆ | Fe(s) | -0,44 | [8] |
| 2 CO2(g) + 2 H+ + 2 e- | ⇆ | HOOCCOOH(aq) | -0,43 | |
| Cr3+ + e- | ⇆ | Cr2+ | -0,42 | |
| Cd2+ + 2 e- | ⇆ | Cd(s) | -0,40 | [8] |
| GeO2(s) + 2 H+ + 2 e- | ⇆ | GeO(s) + H2O | -0,37 | |
| Cu2O(s) + H2O + 2 e- | ⇆ | 2 Cu(s) + 2 OH- | -0,360 | [3] |
| PbSO4(s) + 2 e- | ⇆ | Pb(s) + SO42− | -0,3588 | [3] |
| PbSO4(s) + 2 e- | ⇆ | Pb(Hg) + SO42− | -0,3505 | [3] |
| Eu3+ + e- | ⇆ | Eu2+ | -0,35 | [12] |
| In3+ + 3 e- | ⇆ | In(s) | -0,34 | [2] |
| Tl+ + e- | ⇆ | Tl(s) | -0,34 | [2] |
| Ge(s) + 4 H+ + 4 e- | ⇆ | GeH4(g) | -0,29 | |
| Co2+ + 2 e- | ⇆ | Co(s) | -0,28 | [3] |
| H3PO4(aq) + 2 H+ + 2 e- | ⇆ | H3PO3(aq) + H2O | -0,276 | [3] |
| V3+ + e- | ⇆ | V2+ | -0,26 | [8] |
| Ni2+ + 2 e- | ⇆ | Ni(s) | -0,25 | |
| As(s) + 3 H+ + 3 e- | ⇆ | AsH3(g) | -0,23 | [2] |
| AgI(s) + e- | ⇆ | Ag(s) + I− | -0,15224 | [3] |
| MoO2(s) + 4 H+ + 4 e- | ⇆ | Mo(s) + 2 H2O | -0,15 | |
| Si(s) + 4 H+ + 4 e- | ⇆ | SiH4(g) | -0,14 | |
| Sn2+ + 2 e- | ⇆ | Sn(s) | -0,13 | |
| O2(g) + H+ + e- | ⇆ | HO2(aq) | -0,13 | |
| Pb2+ + 2 e- | ⇆ | Pb(s) | -0,126 | [8] |
| WO2(s) + 4 H+ + 4 e- | ⇆ | W(s) + 2 H2O | -0,12 | |
| P(crveni) + 3 H+ + 3 e- | ⇆ | PH3(g) | -0,111 | [3] |
| CO2(g) + 2 H+ + 2 e- | ⇆ | HCOOH(aq) | -0,11 | |
| Se(s) + 2 H+ + 2 e- | ⇆ | H2Se(g) | -0,11 | |
| CO2(g) + 2 H+ + 2e- | ⇆ | CO(g) + H2O | -0,11 | |
| SnO(s) + 2 H+ + 2 e- | ⇆ | Sn(s) + H2O | -0,10 | |
| SnO2(s) + 4 H+ + 4 e- | ⇆ | SnO(s) + 2 H2O | -0,09 | |
| WO3(aq) + 6 H+ + 6 e- | ⇆ | W(s) + 3 H2O | -0,09 | [2] |
| P(bijeli) + 3 H+ + 3 e- | ⇆ | PH3(g) | -0,063 | [3] |
| Fe3+ + 3 e- | ⇆ | Fe(s) | -0,04 | [11] |
| HCOOH(aq) + 2 H+ + 2 e- | ⇆ | HCHO(aq) + H2O | -0,03 | |
| 2 H+ + 2 e- | ⇆ | H2(g) | 0,0000 | = 0 |
| AgBr(s) + e- | ⇆ | Ag(s) + Br− | +0,07133 | [3] |
| S4O62− + 2 e- | ⇆ | 2 S2O32− | +0,08 | |
| Fe3O4(s) + 8 H+ + 8 e- | ⇆ | 3 Fe(s) + 4 H2O | +0,085 | [13] |
| N2(g) + 2 H2O + 6 H+ + 6 e- | ⇆ | 2 NH4OH(aq) | +0,092 | |
| HgO(s) + H2O + 2 e- | ⇆ | Hg(l) + 2 OH- | +0,0977 | |
| Cu(NH3)42+ + e- | ⇆ | Cu(NH3)2+ + 2 NH3 | +0,10 | [2] |
| Ru(NH3)63+ + e- | ⇆ | Ru(NH3)62+ | +0,10 | [12] |
| N2H4(aq) + 4 H2O + 2 e- | ⇆ | 2 NH4+ + 4 OH- | +0,11 | [4] |
| H2MoO4(aq) + 6 H+ + 6 e- | ⇆ | Mo(s) + 4 H2O | +0,11 | |
| Ge4+ + 4 e- | ⇆ | Ge(s) | +0,12 | |
| C(s) + 4 H+ + 4 e- | ⇆ | CH4(g) | +0,13 | [2] |
| HCHO(aq) + 2 H+ + 2 e- | ⇆ | CH3OH(aq) | +0,13 | |
| S(s) + 2 H+ + 2 e- | ⇆ | H2S(g) | +0.14 | |
| Sn4+ + 2 e- | ⇆ | Sn2+ | +0,15 | |
| Cu2+ + e- | ⇆ | Cu+ | +0,159 | [2] |
| HSO4− + 3 H+ + 2 e- | ⇆ | SO2(aq) + 2 H2O | +0,16 | |
| UO22+ + e- | ⇆ | UO2+ | +0,163 | [12] |
| SO42− + 4 H+ + 2 e- | ⇆ | SO2(aq) + 2 H2O | +0,17 | |
| TiO2+ + 2 H+ + e- | ⇆ | Ti3+ + H2O | +0,19 | |
| SbO+ + 2 H+ + 3 e- | ⇆ | Sb(s) + H2O | +0.20 | |
| AgCl(s) + e- | ⇆ | Ag(s) + Cl− | +0,22233 | [3] |
| H3AsO3(aq) + 3 H+ + 3 e- | ⇆ | As(s) + 3 H2O | +0,24 | |
| GeO(s) + 2 H+ + 2 e- | ⇆ | Ge(s) + H2O | +0,26 | |
| UO2+ + 4 H+ + e- | ⇆ | U4+ + 2 H2O | +0,273 | [12] |
| Re3+ + 3 e- | ⇆ | Re(s) | +0,300 | |
| Bi3+ + 3 e- | ⇆ | Bi(s) | +0,308 | [3] |
| VO2+ + 2 H+ + e- | ⇆ | V3+ + H2O | +0,34 | |
| Cu2+ + 2 e- | ⇆ | Cu(s) | +0,337 | [2] |
| [Fe(CN)6]3− + e- | ⇆ | [Fe(CN)6]4− | +0,36 | |
| Fc+ + e- | ⇆ | Fc(s) | +0,4 | [14] |
| O2(g) + 2 H2O + 4 e- | ⇆ | 4 OH-(aq) | +0,401 | [8] |
| H2MoO4 + 6 H+ + 3 e- | ⇆ | Mo3+ + 2 H2O | +0,43 | |
| CH3OH(aq) + 2 H+ + 2 e- | ⇆ | CH4(g) + H2O | +0,50 | |
| SO2(aq) + 4 H+ + 4 e- | ⇆ | S(s) + 2 H2O | +0,50 | |
| Cu+ + e- | ⇆ | Cu(s) | +0,520 | [2] |
| CO(g) + 2 H+ + 2 e- | ⇆ | C(s) + H2O | +0,52 | |
| I3− + 2 e- | ⇆ | 3 I− | +0,53 | [8] |
| I2(s) + 2 e- | ⇆ | 2 I− | +0,54 | [8] |
| [AuI4]− + 3 e- | ⇆ | Au(s) + 4 I− | +0,56 | |
| H3AsO4(aq) + 2 H+ + 2 e- | ⇆ | H3AsO3(aq) + H2O | +0,56 | |
| AuI2− + e- | ⇆ | Au(s) + 2 I− | +0,58 | |
| MnO4− + 2 H2O + 3 e- | ⇆ | MnO2(s) + 4 OH- | +0,59 | |
| S2O32− + 6 H+ + 4 e- | ⇆ | 2 S(s) + 3 H2O | +0,60 | |
| H2MoO4(aq) + 2 H+ + 2 e- | ⇆ | MoO2(s) + 2 H2O | +0,65 | |
| ⇆ | +0,6992 | [3] | ||
| O2(g) + 2 H+ + 2 e- | ⇆ | H2O2(aq) | +0,70 | |
| Tl3+ + 3 e- | ⇆ | Tl(s) | +0,72 | |
| PtCl62− + 2 e- | ⇆ | PtCl42− + 2 Cl− | +0,726 | [12] |
| H2SeO3(aq) + 4 H+ + 4 e- | ⇆ | Se(s) + 3 H2O | +0,74 | |
| PtCl42− + 2 e- | ⇆ | Pt(s) + 4 Cl− | +0,758 | [12] |
| Fe3+ + e- | ⇆ | Fe2+ | +0,77 | |
| Ag+ + e- | ⇆ | Ag(s) | +0,7996 | [3] |
| Hg22+ + 2 e- | ⇆ | 2 Hg(l) | +0,80 | |
| NO3−(aq) + 2 H+ + e- | ⇆ | NO2(g) + H2O | +0,80 | |
| 2FeO42− + 5 H2O + 6 e- | ⇆ | Fe2O3(s) + 10 OH- | +0,81 | [11] |
| AuBr4− + 3 e- | ⇆ | Au(s) + 4 Br− | +0,85 | |
| Hg2+ + 2 e- | ⇆ | Hg(l) | +0.85 | |
| IrCl62− + e- | ⇆ | IrCl63− | +0,87 | [6] |
| MnO4− + H+ + e- | ⇆ | HMnO4− | +0,90 | |
| 2 Hg2+ + 2 e- | ⇆ | Hg22+ | +0,91 | [2] |
| Pd2+ + 2 e- | ⇆ | Pd(s) | +0,915 | [12] |
| AuCl4− + 3 e- | ⇆ | Au(s) + 4 Cl− | +0,93 | |
| MnO2(s) + 4H+ + e- | ⇆ | Mn3+ + 2 H2O | +0,95 | |
| AuBr2− + e- | ⇆ | Au(s) + 2 Br− | +0,96 | |
| HXeO63− + 2 H2O + 2 e- | ⇆ | HXeO4− + 4 OH- | +0,99 | [15] |
| VO2+(aq) + 2 H+ + e- | ⇆ | VO2+(aq) + H2O | +1,0 | [16] |
| H6TeO6(aq) + 2H+ + 2 e- | ⇆ | TeO2(s) + 4 H2O | +1,02 | [16] |
| Br2(l) + 2 e- | ⇆ | 2 Br− | +1,066 | [3] |
| Br2(aq) + 2 e- | ⇆ | 2 Br− | +1,0873 | [3] |
| IO3− + 5 H+ + 4 e- | ⇆ | HIO(aq) + 2 H2O | +1,13 | |
| AuCl2− + e- | ⇆ | Au(s) + 2 Cl− | +1,15 | |
| HSeO4− + 3 H+ + 2 e- | ⇆ | H2SeO3(aq) + H2O | +1,15 | |
| Ag2O(s) + 2 H+ + 2 e- | ⇆ | 2 Ag(s) + H2O | +1,17 | |
| ClO3− + 2 H+ + e- | ⇆ | ClO2(g) + H2O | +1,18 | |
| HXeO63− + 5 H2O + 8 e- | ⇆ | Xe(g) + 11 OH- | +1,18 | [15] |
| Pt2+ + 2 e- | ⇆ | Pt(s) | +1,188 | [12] |
| ClO2(g) + H+ + e- | ⇆ | HClO2(aq) | +1,19 | |
| 2 IO3− + 12 H+ + 10 e- | ⇆ | I2(s) + 6 H2O | +1,20 | |
| ClO4− + 2 H+ + 2 e- | ⇆ | ClO3− + H2O | +1,20 | |
| O2(g) + 4 H+ + 4 e- | ⇆ | 2 H2O | +1,229 | [8] |
| MnO2(s) + 4 H+ + 2 e- | ⇆ | Mn2+ + 2 H2O | +1,23 | |
| HXeO4− + 3 H2O + 6 e- | ⇆ | Xe(g) + 7 OH- | +1,24 | [15] |
| Tl3+ + 2 e- | ⇆ | Tl+ | +1,25 | |
| Cr2O72− + 14 H+ + 6 e- | ⇆ | 2 Cr3+ + 7 H2O | +1,33 | |
| Cl2(g) + 2 e- | ⇆ | 2 Cl− | +1,36 | [8] |
| CoO2(s) + 4 H+ + e- | ⇆ | Co3+ + 2 H2O | +1,42 | |
| 2 NH3OH+ + H+ + 2 e- | ⇆ | N2H5+ + 2 H2O | +1,42 | [4] |
| 2 HIO(aq) + 2 H+ + 2 e- | ⇆ | I2(s) + 2 H2O | +1,44 | |
| BrO3− + 5 H+ + 4 e- | ⇆ | HBrO(aq) + 2 H2O | +1,45 | |
| ß-PbO2(s) + 4 H+ + 2 e- | ⇆ | Pb2+ + 2 H2O | +1,460 | [2] |
| a-PbO2(s) + 4 H+ + 2 e- | ⇆ | Pb2+ + 2 H2O | +1,468 | [2] |
| 2 BrO3− + 12 H+ + 10 e- | ⇆ | Br2(l) + 6 H2O | +1,48 | |
| 2ClO3− + 12 H+ + 10 e- | ⇆ | Cl2(g) + 6 H2O | +1,49 | |
| HClO(aq) + H+ + 2 e- | ⇆ | Cl−(aq) + H2O | +1,49 | [7] |
| MnO4− + 8 H+ + 5 e- | ⇆ | Mn2+ + 4 H2O | +1.51 | |
| HO2• + H+ + e- | ⇆ | H2O2(aq) | +1,51 | |
| Au3+ + 3 e- | ⇆ | Au(s) | +1,52 | |
| NiO2(s) + 4 H+ + 2 e- | ⇆ | Ni2+ + 2 OH- | +1,59 | |
| Ce4+ + e- | ⇆ | Ce3+ | +1,61 | |
| 2 HClO(aq) + 2 H+ + 2 e- | ⇆ | Cl2(g) + 2 H2O | +1,63 | |
| Ag2O3(s) + 6 H+ + 4 e- | ⇆ | 2 Ag+ + 3 H2O | +1,67 | |
| HClO2(aq) + 2 H+ + 2 e- | ⇆ | HClO(aq) + H2O | +1,67 | |
| Pb4+ + 2 e- | ⇆ | Pb2+ | +1,69 | [2] |
| MnO4− + 4 H+ + 3 e- | ⇆ | MnO2(s) + 2 H2O | +1,70 | |
| AgO(s) + 2 H+ + e- | ⇆ | Ag+ + H2O | +1,77 | |
| H2O2(aq) + 2 H+ + 2 e- | ⇆ | 2 H2O | +1,78 | |
| Co3+ + e- | ⇆ | Co2+ | +1,82 | |
| Au+ + e- | ⇆ | Au(s) | +1,83 | [2] |
| BrO4− + 2 H+ + 2 e- | ⇆ | BrO3− + H2O | +1,85 | |
| Ag2+ + e- | ⇆ | Ag+ | +1,98 | [2] |
| S2O82− + 2 e- | ⇆ | 2 SO42− | +2,010 | [3] |
| O3(g) + 2 H+ + 2 e- | ⇆ | O2(g) + H2O | +2,075 | [12] |
| HMnO4− + 3 H+ + 2 e- | ⇆ | MnO2(s) + 2 H2O | +2,09 | |
| XeO3(aq) + 6 H+ + 6 e- | ⇆ | Xe(g) + 3 H2O | +2,12 | [15] |
| H4XeO6(aq) + 8 H+ + 8 e- | ⇆ | Xe(g) + 6 H2O | +2,18 | [15] |
| FeO42− + 3 e- + 8 H+ | ⇆ | Fe3+ + 4 H2O | +2,20 | [17] |
| XeF2(aq) + 2 H+ + 2 e- | ⇆ | Xe(g) + 2HF(aq) | +2,32 | [15] |
| H4XeO6(aq) + 2 H+ + 2 e- | ⇆ | XeO3(aq) + H2O | +2,42 | [15] |
| F2(g) + 2 e- | ⇆ | 2 F− | +2,87 | [2][6][8] |
| F2(g) + 2 H+ + 2 e- | ⇆ | 2 HF(aq) | +3,05 | [2] |
| 2 KrF2(aq) + 2 e- | ⇆ | 2 KrF+(aq) + F2(g) | +3,27 | [18] |
Izvori
- ↑ Elektrodni potencijal, [1] "Englesko-hrvatski kemijski rječnik & glosar",Eni Generalić, KTF-Split, www.glossary.periodni.com, 2015.
- ↑ 2,00 2,01 2,02 2,03 2,04 2,05 2,06 2,07 2,08 2,09 2,10 2,11 2,12 2,13 2,14 2,15 2,16 2,17 2,18 2,19 2,20 2,21 Bard, A. J., Parsons, R., and Jordan, J. (1985). Standard Potentials in Aqueous Solutions (Marcel Dekker, New York).
- ↑ 3,00 3,01 3,02 3,03 3,04 3,05 3,06 3,07 3,08 3,09 3,10 3,11 3,12 3,13 3,14 3,15 3,16 3,17 3,18 3,19 3,20 3,21 3,22 3,23 3,24 3,25 3,26 3,27
• Nepoznat parametar:.
editor-last
• Nepoznat parametar:editor-first
• Parametarchapternije dopušten u klasibook - ↑ 4,0 4,1 4,2 4,3 Greenwood, Norman N.; Earnshaw, Alan (1997): "Chemistry of the Elements" (2nd ed.). Butterworth-Heinemann. ISBN 0080379419.
- ↑ 5,00 5,01 5,02 5,03 5,04 5,05 5,06 5,07 5,08 5,09 5,10 5,11 5,12 5,13 5,14 Vanýsek, Petr (2011). “Electrochemical Series”, in Handbook of Chemistry and Physics: 92nd Edition (Chemical Rubber Company).
- ↑ 6,0 6,1 6,2 Atkins, Peter (2010) Inorganic Chemistry (5th Edition).
- ↑ 7,00 7,01 7,02 7,03 7,04 7,05 7,06 7,07 7,08 7,09 7,10 7,11 7,12 7,13 7,14 7,15 7,16 7,17 7,18 7,19 7,20 7,21 7,22 7,23 7,24 7,25 7,26 7,27 7,28 7,29 7,30 7,31 7,32 7,33 7,34 7,35 7,36 7,37 7,38 7,39 7,40 7,41 7,42 7,43 7,44 7,45 7,46 7,47 7,48 7,49 7,50 7,51 7,52 7,53 7,54 7,55 7,56 7,57 7,58 7,59 7,60 7,61 7,62 7,63 7,64 7,65 7,66 7,67 7,68 7,69 Lide, David R., ed. (2006). "CRC Handbook of Chemistry and Physics" (87th ed.). Boca Raton, FL: CRC Press..
- ↑ 8,00 8,01 8,02 8,03 8,04 8,05 8,06 8,07 8,08 8,09 8,10 8,11 Peter Atkins (1997). Physical Chemistry, 6th edition (W.H. Freeman and Company, New York).
- ↑ David R. Lide, ed., CRC Handbook of Chemistry and Physics, Internet Version 2005, <http://www.hbcpnetbase.com>, CRC Press, Boca Raton, FL, 2005.
- ↑ Gordon Aylward & Tristan Findlay (2008). "SI Chemical Data", 6th edition (John Wiley & Sons, Australia), ISBN 978-0-470-81638-7.
- ↑ 11,0 11,1 11,2 11,3 11,4 WebElements Periodic Table of the Elements | Iron | compounds information
- ↑ 12,00 12,01 12,02 12,03 12,04 12,05 12,06 12,07 12,08 12,09 Bard, A.J., Faulkner, L.R.(2001). Electrochemical Methods. Fundamentals and Applications, 2nd edition (John Wiley and Sons Inc).
- ↑ Marcel Pourbaix (1966). Atlas of Electrochemical Equilibria in Aqueous Solutions (NACE International, Houston, Texas; Cebelcor, Brussels).
- ↑ • Nepoznat parametar:
issue
• Parametarpmidnije dopušten u klasijournal
• Parametartypenije dopušten u klasijournal
• Parametardatenije dopušten u klasijournal - ↑ 15,0 15,1 15,2 15,3 15,4 15,5 15,6 WebElements Periodic Table of the Elements | Xenon | compounds information
- ↑ 16,0 16,1 Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (1999), "Advanced Inorganic Chemistry" (6th ed.), New York: Wiley-Interscience, ISBN 0-471-19957-5
- ↑ Redox Reactions, Western Oregon University website
- ↑ http://acta.chem-soc.si/60/60-3-455.pdf