Paulijev princip isključenja
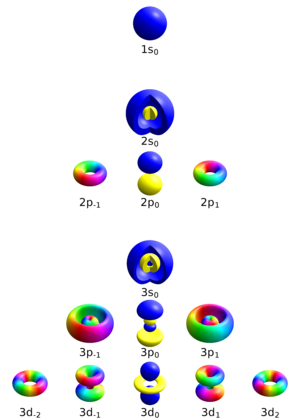

Paulijev princip isključenja, Paulijevo načelo, princip isključenja ili Paulijev princip (po W. Pauliju) je kvantnomehaničko načelo prema kojemu se u atomu svaki elektron nalazi u drugome kvantnom stanju, to jest dva elektrona u kvantnom sustavu ne mogu imati jednake sve kvantne brojeve. Tim se načelom objašnjava elektronska konfiguracija, to jest smještaj elektrona u ljuskama atomskog omotača, a time i periodičnost svojstava kemijskih elemenata. Njemu se podvrgavaju i elektroni u elektronskom plinu u metalima, na čem počiva teorija električne vodljivosti, a objašnjava i mnoga mehanička, električna, magnetska, optička i kemijska svojstva krutih tvari. Pauli je to načelo objasnio (formulirao) 1925. za elektrone, a 1940. ga je protegnuo od elektrona na sve fermione, čestice s polucijelim spinom. U općem objašnjenju, Paulijevo načelo izriče da valna funkcija mora biti antisimetrična pri zamjeni dvaju fermiona, odnosno simetrična pri zamjeni para bozona. To se načelo pokazuje važnim za stabilnost atoma i kemijskih tvari općenito. [1]
Jedna od posljedica principa isključenja jest činjenica da postoje razni kemijski elementi, jer kada on ne bi vrijedio, tada bi svi elektroni u atomu zauzeli najniže energetsko stanje, te bi po kemijskim svojstvima bili jednaki. Elektroni atoma težih od helijevih ne zauzimaju najniže energetsko stanje, jer dva elektrona u istom atomu ne mogu imati sva četiri kvantna broja (n, l, ml i ms) jednaka, što znači da ne mogu biti opisana jednakom valnom funkcijom.
Kvantni brojevi i Paulijevo načelo
Da dobijemo grubu sliku atoma, možemo zanemariti sile između elektrona. Tad se svaki elektron kreće oko atomske jezgre u stazama. Ova gruba slika atoma omogućuje nam da nađemo kvantne brojeve i stacionarna stanja elektrona, koji se dobivaju i u preciznijim modelima atoma.
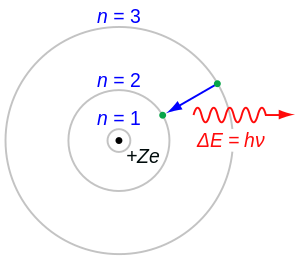
Iz rendgenskih spektara se vidi da glavni kvantni broj n, kojim su dane vodikove energije, određuje pojedine ljuske atoma. U Bohrovu modelu vodika glavni kvantni broj određuje veliku poluos eliptične staze elektrona. Prema tom glavnom kvantnom broju obilježavaju se pojedine ljuske:
| n = | 1 | 2 | 3 | 4 | 5 | 6 |
|---|---|---|---|---|---|---|
| ljuska | K | L | M | N | O | P |
n = 1 odgovara stabilnom stanju, n = 2 prvom pobuđenom nivou i tako dalje. Prema tome, K ljuska predstavlja energetski najnižu, najstabilniju ljusku, L ljuska prvu iznad najniže, i tako dalje.
U Bohrovu modelu pripada glavnom kvantnom broju više elipsa. Iznimku čini najniža ljuska n = 1, kojoj odgovara samo jedna kružnica. Koliki je glavni kvantni broj n, toliko ima različitih elipsa. One odgovaraju različitim diskretnim vrijednostima impulsa vrtnje. Drugoj ljuski odgovaraju u Bohrovu modelu dva različita impulsa vrtnje sa nφ = 1, nφ = 2 i nφ = 3. Vidi se kako to ide kod viših ljusaka.
Ovdje treba da se osvrnemo na bitnu promjenu koju je na Bohrovu modelu izvršila stroga kvantna mehanika (W. Heisenberg, E. Schrödinger). Prema strogoj kvantnoj mehanici impuls vrtnje elektrona oko jezgre može biti i jednak nuli. To je upravo ono što smo prije kod vodika isključili. Rekli smo da bi tad elektroni titrali u pravcu i prolazili kroz jezgru. Međutim, za strogu kvantnu mehaniku ne postoje takve teškoće, jer se ona u samom početku odrekla naivnih zornih slika. Iskustvo je dalo pravo modernoj kvantnoj teoriji. Po Bohru bi se elektron u stabilnom stanju vodikova atoma morao vrtjeti u kružnici i imati impuls vrtnje h/2∙π. Stern i Gerlach uspjeli su da točno izmjere impuls vrtnje i magnetski moment vodikova atoma. Prolazeći kroz nehomogeno magnetsko polje, vodikove se zrake cijepaju u dva snopa. Ovaj dvolom odgovara momentu impulsa 1/2∙h/2∙π. Jedini impuls vrtnje, što ga ima vodikov atom u stabilnom stanju, potječe od spina. I za druge atome dokazao je to isto. Impulsi vrtnje mogu, dakle, poprimiti i vrijednost nula.
Mjesto starog kvantnog broja nφ uvest ćemo novi kvantni broj vrtnje l, tako da on poprima redom vrijednosti 0, 1, 2, 3, … Najveća vrijednost, koju taj kvantni broj u pojedinoj ljuski može imati, iznosi n - 1. Imamo opet, kao i u staroj kvantnoj teoriji, za svaku ljusku n različitih vrtnja. Kod K ljuske je l = 0, kod L ljuske l = 0 i l = 1, kod M ljuske je l = 0, l = 1 i l = 2. Evo kako to ide dalje:
| n = 1 | n = 2 | n = 3 | n = 4 | n = 5 |
|---|---|---|---|---|
| l = 0 | l = 0 | l = 0 | l = 0 | l = 0 |
| l = 1 | l = 1 | l = 1 | l = 1 | |
| l = 2 | l = 2 | l = 2 | ||
| l = 3 | l = 3 | |||
| l = 4 |
Time su iscrpljeni svi tipovi staza. Međutim, kako znamo, ravnina gibanja elektrona oko jezgre može još imati različite položaje u prostoru. Iz Zeemanova učinka i Stern-Gerlachovih pokusa zaključili smo da su moguće one orijentacije momenta impulsa kod kojih su projekcije na zadani smjer jednake m∙h/2∙π. Magnetski kvantni broj m poprima sve cijele brojeve od - l do + l. Moguće vrijednosti magnetskog kvantnog broja m zabilježene su u tablici:
| l = 0 | 0 | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| l = 1 | - 1 | 0 | + 1 | ||||||
| l = 2 | - 2 | - 1 | 0 | + 1 | + 2 | ||||
| l = 3 | - 3 | - 2 | - 1 | 0 | + 1 | + 2 | + 3 | ||
| l = 4 | - 4 | - 3 | - 2 | - 1 | 0 | + 1 | + 2 | + 3 | + 4 |
Kvantnom broju l pripada 2∙l + 1 različitih vrijednosti magnetskog kvantnog broja.
U Bohr-Sommerfeldovoj teoriji 3 kvantna broja n, l i m određuju stazu elektrona, i oblik elipse i njen nagib prema određenom smjeru. Iste te kvantne brojeve preuzela je i stroga kvantna mehanika, samo što su oni izgubili ono zorno značenje koje im je pripisivala stara teorija.
Još nismo potpuno odredili stanje elektrona. Treba da uzmemo u obzir i vlastitu vrtnju elektrona (spin). Kako smo vidjeli iz Stern-Gerlachovih pokusa, moguće su samo dvije orijentacije spina prema magnetskom polju: paralelna i antiparalelna. Prema tome uvest ćemo kvantni broj spina s, koji može poprimiti samo dvije vrijednosti:
- s = - 1/2 i s = + 1/2
Paralelnom smjeru odgovara moment impulsa + 1/2∙h/2∙π, a antiparalelnom - 1/2∙h/2∙π. Drugih vrijednosti spin nema.
Kvantni brojevi n, l, m i s točno određuju pojedino stacionarno stanje elektrona u atomu vodika. Čim odaberemo 4 vrijednosti kvantnih brojeva, utvrdili smo točno gibanje elektrona.
Kvantni brojevi n, l, m i s točno određuju pojedino stacionarno stanje i za druge elemente, ukoliko zanemarimo sile između elektrona. Tad se opet elektroni kreću u elipsama oko atomske jezgre, samo što je sad naboj jezgre jednak Ze. Želimo li od te slike atoma učiniti korak dalje, moramo uzeti u obzir i sile između elektrona. No, i sada se mogu upotrijebiti stari kvantni brojevi. Uzajamne sile elektrona modificiraju gibanje elektrona, ali one ne razaraju stara stacionarna stanja i ne stvaraju nova. Kad uzmemo u račun međusobne sile elektrona, tad se, u prvom redu mijenjaju energije samih prvobitnih stacionarnih stanja. Stacionarna stanja iste ljuske nemaju više jednaku energiju. Kako smo već prije vidjeli, energija se to jače snizuje što je kvantni broj l manji (staze prodiru u unutarnje ljuske!). Svaki vodikov energetski nivo raspada se na skupinu usko priljubljenih nivoa. Ali sam broj stacionarnih stanja ostaje isti, a to je upravo najvažnije za teoriju periodnog sustava.
Središnje je pitanje teorije kako su smješteni elektroni na pojedina stacionarna stanja. Činjenice o rendgenskim spektrima pokazale su, da nikako ne možemo pretpostaviti da se svi elektroni nalaze u najnižem stacionarnom stanju. Kod teških atoma nalaze se elektroni u L, M i N ljuski. Nešto sprečava da ti elektroni na padnu na najnižu ljusku, što bi značilo stanje najniže energije, dakle najveće stabilnosti.
Ključ po kojemu su elektroni raspoređeni na različita stacionarna stanja pruža takozvano Paulijevo načelo isključenja. To načelo od temeljnog je značenja za teoriju kemijskih elemenata i njihovih spektara. Po tom načelu može isto kvantno stanje zaposjesti samo jedan elektron. Isključeno je da u atomu dva elektrona imaju iste kvantne brojeve n, l, m i s.
Paulijevo načelo dokazano je nizom spektroskopskih pokusa. On je vodič kroz složeni periodni sustav elemenata. [2]
Izvori
- ↑ Paulijevo načelo (Paulijev princip), [1] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2019.
- ↑ Ivan Supek: "Nova fizika", Školska knjiga Zagreb, 1966.