Difuzija
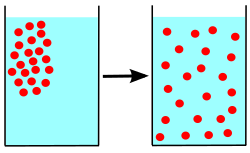
Difuzija (lat. diffusio: širenje, rasprostiranje, raspršenje) je prijenos kemijskih tvari u plinovima, kapljevinama i čvrstim tvarima. Nastaje zbog razlike u koncentracijama koje se spontanim toplinskim gibanjem čestica izjednačuju. Za razliku od plinova i kapljevina, gdje toplinsko gibanje čestica (molekula, iona, koloidnih čestica) uzrokuje međusobno miješanje dviju ili više tvari, u čvrstim tvarima atomi i ioni difuzijom mijenjaju mjesta u kristalnoj rešetki. Difuzija je najbrža u plinovima, sporija u kapljevinama, a najsporija u čvrstim tvarima. Brzina difuzije neke tvari u danom smjeru proporcionalna je njezinu koncentracijskom gradijentu (1. Fickov zakon difuzije), a općenito se povećava s porastom temperature (jer se čestice gibaju brže) i smanjuje s porastom gustoće. Kapljevine različitih molekularnih masa koje se međusobno mogu miješati (na primjer voda i alkohol) difundirat će jedna u drugu. Ioni ili molekule čvrstih tvari otopljenih u otapalu (na primjer sol ili šećer u vodi) difundirat će dok se ne postigne njihova jednolika koncentracija u otopini. Dva metala u dodiru pokazuju malu ali jasnu težnju međusobne difuzije. Difuzija je moguća i kroz polupropusnu membranu, na primjer pri osmozi i dijalizi. Difuzija je vrlo važna za odvijanje mnogih bioloških (osmoza) i kemijskih reakcija. Brzina kemijske reakcije često je određena brzinom difuzije reagirajućih čestica, posebno u reakcijama čvrstih tvari. Na difuziji se temelje i mnoge tehnološke operacije, proizvodnja elektroničkih elemenata u mikroelektronici i poluvodičkoj tehnici, promjenom svojstava površinskih slojeva u metalurgiji, djelovanje difuzijskih vakuumskih sisaljki i drugo.[1]
Bitno je napomenuti da je difuzija miješanje kemijskih tvari bez ikakvog vanjskog utjecaja. Ta se pojava zbiva uslijed gibanja molekula, koje zbog svoje brzine prodiru u susjedne tvari. Na primjer ako u epruvetu ulijemo otopinu modre galice CuSO4, a iznad nje nalijemo vodu, te epruvetu pustimo neko vrijeme na miru, vidjet ćemo da će otopina modre galice, i ako je teža od vode, prodirati u vodu. U tehnici se difuzija iskorišćuje za odjeljivanje plinova različitih molekularnih masa, a isto tako i za dobivanje izotopa. Plinovi vrše difuziju, to jest difundiraju u krute tvari, pa se ta difuzija naziva adsorpcija. Difuzija plinova u tekućine naziva se apsorpcija. Apsorpcija se primjenjuje za postizavanje vakuuma u elektronskim cijevima. Pokusi su pokazali da je količina apsorbiranog plina u tekućini to veća što je veći tlak iznad tekućine i što je niža temperatura tekućine.[2]
Fickovi zakoni difuzije čestica
Fickovi zakoni difuzije čestica ili molekulske difuzije tumače osnovne pojave pri difuziji. 1. Fickov zakon:
- Obrada nije uspjela. (Conversion error. Server ("https://wikimedia.org/api/rest_") reported: "Cannot get mml. Server problem."): {\displaystyle N=-D\cdot {\frac {dc}{dx}}\ }
daje ovisnost toka čestica N o gradijentu koncentracije dc/dx, a D je koeficijent difuzije, ovisan o vrsti čestica koje se gibaju i sredstvu u kojem se difuzija odvija.
2. Fickov zakon:
- Obrada nije uspjela. (MathML sa SVG ili PNG za rezervu (preporučljivo za moderne preglednike i alate za pristupačnost): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \frac{d c}{d t} = D \cdot \frac{d ^2c}{d x^2} \ }
daje ovisnost promjene koncentracije čestica s vremenom o drugoj derivaciji koncentracije po koordinati u smjeru koje se proces difuzije odvija.[3]
Osmoza
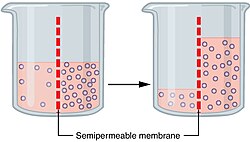
Difuzija se ne zbiva samo između kemijskih tvari koje se dodiruju, nego također između tvari koje su odijeljene nekom pregradom, odnosno membranom. Osim toga, difuzija tekućine može postojati i kroz pregrade nasuprot sili teži, i to s izvjesnim tlakom koji se naziva osmotski tlak. Ako na primjer odijelimo otopinu modre galice i vodu nekom membranom (na primjer životinjskim mjehurom) vidjet ćemo da voda mnogo brže prodire kroz membranu u modru galicu nego modra galica u vodu. Voda će dotle prodirati dok ne nastupi ravnoteža između hidrostatskog i osmotskog tlaka.
Difuzija kroz propusne ili polupropusne membrane (stijenke) naziva se osmoza. Tlak koji zbog različite koncentracije otopina tjera tekućinu u smjeru veće koncentracije naziva se osmotski tlak. Pri dodiru dviju tekućina različitih koncentracija tekućine nastoje svoju koncentraciju izjednačiti difuzijom. Budući da molekule modre galice ne mogu tako brzo prolaziti kroz polupropusnu membranu u vodu, to se koncentracija izjednačuje na taj način da voda prodire u otopinu modre galice i njezinu koncentraciju izjednačuje.
Osmotski tlak je kod nekih otopina vrlo velik, tako je na primjer kod šećerne otopine 60 000 N/mm2 (0,6 bar). Osmoza je važna za žive organizme. Stijenke stanica su opne koje propuštaju samo one tvari koje su organizmu potrebne za hranu.
Izvori
- ↑ difuzija, [1] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2017.
- ↑ Velimir Kruz: "Tehnička fizika za tehničke škole", "Školska knjiga" Zagreb, 1969.
- ↑ Fickovi zakoni difuzije čestica (molekulske difuzije), [2] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2017.
- Tehnički leksikon, Leksikografski zavod Miroslav Krleža; glavni urednik: Zvonimir Jakobović. Tiskanje dovršeno 21. prosinca 2007.g., Nacionalne i sveučilišne knjižnice u Zagrebu pod brojem 653717. ISBN 978-953-268-004-1, str. 145.