Hem
Hem je prostetička grupa koja se sastoji od atoma željeza smještenog u centru velikog heterocikličnog organskog prstena porfirina. Iako postoje porfirini bez željeza, najveći dio metaloproteina koji sadrže porfirine ima hem kao prostetičku grupu. Oni su poznati kao hemoproteini.
Funkcija
Hemoproteini imaju raznovrsne biološke funkcije među kojima je prijenos plinova u krvi, kemijska kataliza, detekcija plinova i prijenos elektrona. Željezo hema služi kao izvor ili primatelj elektrona tijekom prijenosa elektrona u redoks reakcijama. U peroksidaznim reakcijama, molekula porfirina također služi kao izvor elektrona. Pri prijenosu ili detekciji dvoatomskih plinova kao primjerice kisika, plin se veže za molekulu željeza unutar hema. Tijekom detekcije dvoatomskih plinova, vezivanje plinovitog liganda za željezo u hemu uzrokuje konformacijske promjene bjelančevine koja ga sadrži.
Pretpostavlja se da je prvobitna evolucijska uloga hemoproteina bila prijenos elektrona u primitivnim, na sumporu baziranim fotosintetičkim putovima u drevnim cijanobakterijama prije pojave molekularnog kisika.[1]
Hemoproteini ostvaruju svoju izvanrednu funkcionalnu raznovrsnost putem promjene okruženja hemovog makrociklusa unutar matriksa same bjelančevine. Na primjer, sposobnost hemoglobina učinkovito isporučiti kisik tkivima je posljedica specifičnih aminokiselinskih ostataka smještenih u blizini hema. Hemoglobin veže kisik u plućnom krvotoku, gdje je pH visok i pCO2 nizak, a otpušta ga u tkivima, gdje je situacija obrnuta. Taj fenomen je poznat kao Bohrov efekt. Molekularni mehanizam na kome se ovaj efekt temelji je sterična organizacija globinskog lanca; histidinski ostaci, smješteni u blizini hema, postaju električno pozitivno nabijeni u kiselim uvjetima (niskim pH) (kao posljedica otopljenog CO2 u krvi), što dovodi do otpuštanja kisika s hem grupe.
Vrste molekula hema
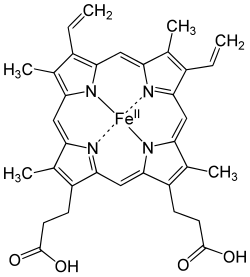
Postoji nekoliko biološki važnih vrsta hema:
| hem a | hem b | hem c | hem o | ||
|---|---|---|---|---|---|
| PubChem - broj | 7888115 | 444098 | 444125 | 6323367 | |
| Kemijska formula | -{C49H56O6N4Fe}- | -{C34H32O4N4Fe}- | -{C34H36O4N4S2Fe}- | -{C49H58O5N4Fe}- | |
| Funkcionalna grupa na -C3 | Datoteka:Porphyrin Numbering.png | -CH(OH)CH2Far* | -CH=CH2 | -CH-(cistein-S-il)CH3 | -CH(OH)CH2Far* |
| Funkcionalna grupa na -C8 | -CH=CH2 | -CH=CH2 | -CH(cistein-S-il]])CH3 | -CH=CH2 | |
| Funkcionalna grupa na -C18 | -CH=O | -CH3 | -CH3 | -CH3 | |
Far* = farnezen
Najrasprostanjeniji tip je hem B dok su drugi važni tipovi hem A [2] i hem C. Izolirane molekule hema se obično obilježavaju velikim slovima, dok se molekule hema vezane za bjelančevine označavaju malim slovima. Citokrom a je hem A u kombinaciji s posebnom membranskom bjelančevinom koji formira dio citohrom c oksidaze.
Sinteza
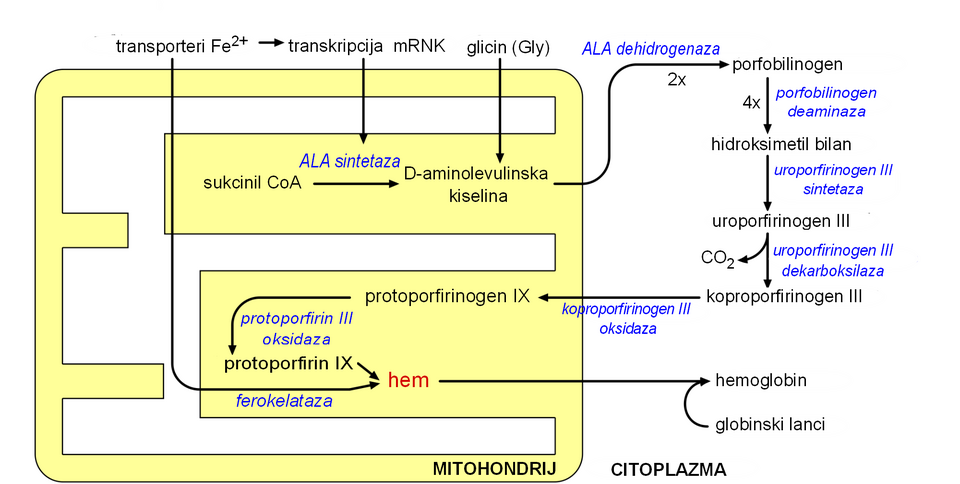
Enzimski proces kojim se formira hem zove se sinteza porfirina, jer su svi međuspojevi tetrapiroli koji su kemijski klasificirani kao porfirini. Ovaj je proces vrlo očuvan kod mnogih vrsta živih bića. Kod ljudi, taj se metabolički put gotovo isključivo koristi za sintezu hema. Kod drugih vrsta, ovim se procesom proizvode slični spojevi, kao što je kobalamin (vitamin B12).
Proces započinje sintezom D-aminolevulinske kiseline (dALA ili δALA) iz aminokiseline glicina i sukcinil CoA iz Krebsovog ciklusa. Enzim koji katalizira ovu reakciju, ALA sintetaza, je ograničavajući faktor u sintezi hema. On je precizno reguliran količinom unutarstaničnog željeza i koncentracijom hema. Nizak nivo željeza dovodi do smanjenja sinteze porfirina, što sprječava akumulaciju toksičnih međuspojeva. Ovaj mehanizam ima terapeutski značaj: infuzija hem arginata ili hematina može spriječiti napad porfirije kod pacijenata sa urođenom metaboličkom greškom tog procesa, putem redukcije transkripcije ALA sintaze.
Sinteza hema se uglavnom zbiva u jetri i koštanoj srži.
Degradacija
Degradacija počinje unutar makrofaga slezene, koji uklanjaju stare i oštećene eritrocite iz krvotoka. U prvom koraku, hem se konvertira u biliverdin, enzimom hem oksigenaza (HOXG). NADPH ima ulogu redukcijskog faktora. Molekularni kisik je supstrat iz koga se formira CO, a željezo se oslobađa iz molekule kao ferični ion (Fe3+).
Biliverdin se zatim konvertira u bilirubin posredstvom biliverdin reduktaze (BVR).
Bilirubin se transportira u jetru vezan za krvnu bjelančevinu albumin, gdje se veže s glukuronskom kiselinom, što povećava njegovu topljivost u vodi.
Ta je reakcija katalizirana enzimom UDP-glukuronid transferaza (UDPGUTF). Ovaj se oblik bilirubina izlučuje iz jetre u žuč. Crijevne bakterije odvajaju glukuronsku kiselinu i konvertiraju bilirubin u urobilinogen. Dio je urobilinogena absorbiran od crijevnih stanica, stoga se krvotokom prenosi do bubrega i izlučuje putem urina. Ostatak ide u probavni trakt i konvertira se u sterkobilinogen. Sterkobilinogen se oksidira u sterkobilin, koji se izlučuje, i koji daje karakterističnu boju izmetu.
Degradacija hema je evolucijski vrlo očuvan odgovor na oksidacijski stres. U slučaju izloženosti slobodnim radikalima, stanica vrlo brzo povećava proizvodnju izoenzima oksigenaze-1 (HMOX1) koji katabolizira hem. Razlog za eksponencijalno povećanje sposobnosti stanice da razgradi hem, kao odgovor na oksidacijski stres nije jasan. Smatra se da je to zaštitni mehanizam stanice kojim se izbjegavaju štetni učinci slobodnog hema.


