Razlika između inačica stranice »Albrecht Kossel«
(Bot: Automatski unos stranica) |
m (bnz) |
||
| Redak 1: | Redak 1: | ||
{{Znanstvenik | |||
| ime = Albrecht Kossel | | ime = Albrecht Kossel | ||
| slika = Albrecht Kossel nobel.jpg | | slika = Albrecht Kossel nobel.jpg | ||
Trenutačna izmjena od 11:22, 29. travnja 2022.
- PREUSMJERI Predložak:Infookvir znanstvenik


Albrecht Kossel, punim imenom Ludwig Karl Martin Leonhard Albrecht Kossel (Rostock, 16. rujna 1853. - Heidelberg, 5. srpnja 1927.), njemački liječnik i biokemičar. Studirao je medicinu u Strasbourgu i Rostocku, potom bio profesor na sveučilištima u Marburgu i Heidelbergu. Istraživao je biokemiju tkivâ, stanica i posebno staničnih jezgara. Otkrio da se "nuklein" (nukleoprotein) sastoji od dviju komponenata, bjelančevine i nukleinske kiseline. Godine 1910. dobio je Nobelovu nagradu za fiziologiju ili medicinu. Zaslužan je za odvajanje biokemije od fiziologije na njemačkim sveučilištima. [1]
Životopis
Kossel je rođen u Rostocku kao sin pruskog glavnog konzula Albrechta Kossela i njegove žene Clare. Godine 1872. Kossel je pohađao studij medicine na Sveučilištu u Strasbourgu, gdje je slušao predavanja poznatih predavača: Anton de Bary, Waldeyer, Kundt, Baeyer i Felix Hoppe-Seyler.
Diplomirao je 1878. na Sveučilištu u Rostocku. Kossel je 1910. dobio Nobelovu nagradu za fiziologiju ili medicinu za svoje istraživanje biologije stanice, posebno proteina i nukleinskih kiselina. Također je otkrio i aminokiselinu histidin (1896.), timinsku kiselinu i agmatin (1910.). Kosselovo područje rada bila je (fiziologija) kemija tkiva i stanica. Potkraj 1880. počeo je svoj istraživanje ustroja stanične jezgre, da bi u 1890-tima počeo svoje istraživanje proteina. Istraživao je promjene u proteinima pri prelasku u peptide, učinke fenetol dijete na urin i peptidne dijelove stanice. 1896. otkrio je histidin, te razvio klasičnu kvanitativnu metodu za odvajanje heksoza baza. Zajedno sa svojim poznatim engleskim učenikom H. D. Dakin istraživao je arginazu, enzim koji hidrolzira arginin u ureu i ornitin. Kasnije je otkrio agmatin u ikri haringe i opisao metodu za dobivanje.
Jedan od Kosselovih studenata bio je amerikanac biokemičar Edwin B. Hart, koji je nakon povratka u SAD sudjelovao u timu koji je utvrdio prehrambene uzroke anemije i guše.
Kossel je imao kćer, i sina, Walther (1888. – 1956.), koji je bio ugledni profesor teorijske fizike na Institutu tehnologije u Danzigu (1932. – 1945.).
Periferna i centralna svojstva atoma
Periodičnost se ne pojavljuje samo u kemijskim svojstvima kemijskih elemenata nego također i u mnogim fizičkim osobinama. Tako je u isto vrijeme kad je Mendeljev postavio svoj periodni sustav elemenata, našao J. L. von Meyer da se atomski volumeni periodički mijenjaju s atomskom težinom kemijskih elemenata.
Ako se kao ordinata atomski volumen, pomnožen sa L, a kao apscisa redni broj, periodički tok atomskih volumena udara odmah u oči. Maksimum leži kod alkalijskih elemenata. Vidimo dalje da elementi na početku redova u sustavu Mendeljeva imaju najveće atomske volumene. Male vrhove imaju još elementi rijetke zemlje europij i iterbij. Zanimljiv je i sam oblik krivulje. Maksimumi su vrlo strmi, naprotiv, minimumi su plosnati. Opaža se još da vrhovi krivulje postaju sve viši. Atomski volumeni pomalo rastu kad se povećava redni broj.
I još mnoga druga svojstva ovise periodički od rednog broja elementa. Takvu periodičnost pokazuju na primjer paramagnetična svojstva, kompresibilnost, koeficijent rastezanja, recipročna temperatura taljenja i tako dalje. Srodni kemijski elementi kristaliziraju se u jednakim kristalnim rešetkama. Periodičnost ide vrlo daleko.
Pokušajmo sada da te rezultate objasnimo predodžbama koje smo stekli o strukturi atoma. Kemijski afinitet i valencija, atomski volumen, kompresibilnost, koeficijent rastezanja, kristalizacija i tako dalje, sva ta svojstva određena su periferijom atoma. Dolazimo, prirodno, do zaključka da se periferija atoma periodički mijenja od najlakših do najtežih atoma.
Razmotrimo dvije susjedne grupe elemenata: plemenite plinove i alkalijske metale. Iako na primjer natrij ima samo jedan elektron više od neona, oni se ipak temeljito razlikuju. Svi alkalijski metali rado stupaju u molekularne spojeve, a njihovim atomima vrlo je lako otkinuti jedan elektron. Naprotiv, plemeniti plinovi ne udružuju se u molekule i teško se ioniziraju. Premda su im mase bliske, atomski volumeni alkalijskih metala znatno su veći od atomskih volumena plemenitih plinova. Sve te kemijske i fizičke činjenice navode na pomisao, da su u atomima plemenitih plinova elektroni poredani u čvrstu ljusku, dok se, naprotiv, kod alkalijskih metala jedan elektron kreće podalje od ostalog atomskog trupa. Čini se da čitava razlika između plemenitih i alkalijskih metala potječe od jednog vanjskog elektrona. Alkalijski metali imaju jedan labavo vezan elektron izvan čvrstog trupa i taj prouzrokuje snažan kemijski afinitet, lako ioniziranje i veliki atomski volumen. Značenje vanjskih elektrona u punom opsegu je spoznao N. Bohr. Kemijska svojstva elemenata određena su vanjskim elektronima atoma. Unutarnjim elektronima ne pripada veće značenje. Oni služe da se neutralizira pozitivni električni naboj atomske jezgre.
Bohrov zaključak o ulozi vanjskih elektrona neosporno potvrđuju atomski spektri. Optički spektri očituju istu periodičnost kao i ostala kemijska i fizička svojstva elemenata. Svi srodni elementi emitiraju spektralne linije, koji se daju srediti po istim zakonima. Tako na primjer spektri svih alkalijskih metala nalikuju na vodikov spektar. J. Rydberg i W. Ritz su našli da se s malim izmjenama daju prikazati Balmerovim jednadžbama. Tu sličnost neposredno objašnjuje naša hipoteza da se kod alkalijskih metala jedan elektron kreće izvan ostalog atomskog trupa. Na taj vanjski elektron djeluje atomska jezgra i unutarnji elektroni, pa je ukupna sila takva kao da na njega djeluje sama vodikova jezgra. Optički spektar alkalijskih metala potječe od kvantnih skokova vanjskog elektrona, koji poprima energetske nivoe, slične vodikovu atomu.
Sličan spektar pokazuju i svi metali alkalijskih zemalja. U njihovim spektrima očituju se isti zakoni koji vladaju emisijom helija. Kako ćemo još vidjeti, helijev spektar je protumačen na osnovu predodžbe da se oko helijeve jezgre kreću dva elektrona. Budući da metali alkalijskih zemalja imaju isti spektar, moraju se i kod njih dva elektrona nalaziti izvan unutarnjih ljusaka. Taj zaključak potkrepljuje i činjenica da se metalima alkalijskih zemalja lako otrgnu dva elektrona od njihovih atoma.
Optičkim spektrima je izvor u kvantnim procesima na periferiji atoma. Važnu podršku tome shvaćanju pružili su A. Sommerfeld i A. Kossel razmatrajući spektre ioniziranih atoma. Da se dobiju takvi spektri, najprije se atomima oduzima jedan ili više elektrona, a zatim se pobude na emisiju svjetlosti. Sommerfeld i Kossel su našli, da se spektri ioniziranih elemenata podudaraju sa spektrima neutralnih elemenata, koji im prethode u kemijskom sistemu. U atomima ioniziranih metala alkalijskih zemalja samo se još jedan elektron vrti oko unutarnjeg atomskog trupa, pa se njihov spektar mora podudarati sa spektrom alkalijskih metala. Isti takav pomak u spektru opaža se i kod aluminija, koji slijedi iza alkalijske zemlje magnezija. Ako aluminijevim atomima otrgnemo jedan elektron, tad oni imaju spektar nalik na magnezij. Ako im oduzmemo dva elektrona, tada im je spektar nalik na natrij. Sommerfeld-Kosselov zakon o spektralnom pomaku očito dokazuje da su za optičke spektre važni samo vanjski elektroni. Periodičnost u fizičkim i kemijskim osobinama elemenata jasan je znak da se pri postepenoj izgradnji atoma iz elektrona ponavljaju na periferiji slične situacije.
Da se atomi pobude na emisiju optičkog spektra, mora se poremetiti njihova površina. Najpoznatije takvo sredstvo je ugrijavanje. Brzi atomi se međusobnim srazovima mogu izbaciti iz stabilnih stanja. Što više ugrijemo neki plin, to jače međusobni naleti narušuju ravnotežu na površini atoma. Izbačen iz stabilnog stanja, atom se vraća natrag na emisiju svjetla. Atome možemo pobuditi također električnom iskrom ili udarima brzih elektrona. Svi takvi učinci zbivaju se na površini atoma, što neosporno pokazuje gdje je porijeklo optičkih spektara.
Sasvim je drukčije kod rendgenskih spektara. Tu nema ni traga nekoj periodičnosti. Kako smo prije vidjeli, prodornost svojstvenih rendgenskih zraka monotono raste, kako se povećava redni broj elemenata. Iz valnih duljina rendgenskog spektra možemo po Moseleyevu zakonu zaključiti kolik je redni broj elemenata, i obrnuto, iz rednog broja možemo proračunavati valne duljine rendgenskog spektra. Iz samog načina kako pobuđujemo rendgenske linije, moramo zaključiti, da one potječu iz unutrašnjosti atoma. Unutrašnjost atoma ne očituje, dakle, periodičnosti. Unutrašnjost atoma mijenja se monotono s rednim brojem elemenata.
Dosadašnja iskustva, koja smo stekli o optičkim i rendgenskim spektrima, kao i o drugim fizičkim i kemijskim svojstvima elemenata, pružaju nam jasan putokaz u strukturi atoma. Svi teži atomi imaju nekoliko ljusaka oko jezgre. Najdonje ljuske popunjene su elektronima. U vanjskoj ljuski ima mjesta za više elektrona. Kod alkalijskih elemenata u vanjskoj se ljuski nalazi jedan elektron, kod metala alkalijskih zemalja dva, i tako dalje. Vanjska ljuska potpuno se popunjava kod plemenitih plinova. Vidimo da početak svake periode u sustavu Mendeljejeva znači jednu novu ljusku, a kraj periode potpuno popunjenje te ljuske.
Halogenim elementima, koji stoje ispred plemenitih plinova, nedostaje upravo jedan elektron da popune vanjsku ljusku. Prema tome, halogeni elementi "žeđaju" za elektronima. Naprotiv, alkalijski elementi rado odbacuju svoj vanjski elektron, jer tada ostaju s potpuno popunjenim ljuskama. To nam neposredno objašnjava zašto su neke skupine elemenata elektropozitivne, a druge elektronegativne. Odbacujući elektrone, alkalijski metali, metali alkalijskih zemalja i zemlje stvaraju pozitivne ione. Naprotiv, uzimajući elektrone iz okoline, halogeni elementi, kisikova i dušikova skupina, stvaraju negativne ione. Kod svih tih elemenata opaža se težnja ka stvaranju popunjenih ljusaka, što prestavlja najbolju ravnotežu. Takva stabilizacija postignuta je trajno kod plemenitih plinova. Prema tome možemo reći da svi elementi teže da svoju periferiju urede prema plemenitim plinovima.
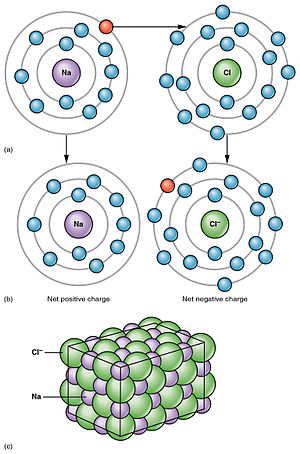
Kossel je pomoću tih predodžba prvi protumačio narav polarnih spojeva. Takav jedan polarni spoj je kuhinjska sol NaCl. Vanjski elektron natrija preskače kloru. Na taj način ostaje natrijev atom samo s unutarnjim, popunjenim ljuskama, a klor upravo popunjava svoju vanjsku ljusku. Imamo sad dva atoma s potpuno zatvorenim vanjskim ljuskama. Periferija jednog atoma liči sad na neon, a drugog na argon. Simbolički to možemo pisati:
- Na+Cl- = 11Ne17Ar
Donjim indeksima označili smo da dobiveni "neon" ima jezgru natrija, a "argon" klora. [2]
Izabrana djela
- "Istraživanje jezgre i njenih raspadnih produkata" (Untersuchungen über die Nukleine und ihre Spaltungsprodukte, 1881. g.),
- "Tkiva ljudskog tijela i njihov mikroskopski pregled" (Die Gewebe des menschlichen Körpers und ihre mikroskopische Untersuchung, 1889.-1891. g.),
- "Udžbenik za medicinsko-kemijske smjerove" (Leitfaden für medizinisch-chemische Kurse, 1888. g.),
- "Problemi biokemije" (Die Probleme der Biochemie, 1908. g.),
- "Odnos između kemije i fiziologije" (Die Beziehungen der Chemie zur Physiologie, 1913. g.).
Izvori
- ↑ Kossel, Albrecht, [1] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2019.
- ↑ Ivan Supek: "Nova fizika", Školska knjiga Zagreb, 1966.
Vanjske poveznice
- (engl.)Nobelova nagrada - životopis