Polarnost
- Polarnost je neravnomjerna raspodjela električnoga naboja u molekuli ili kemijskoj vezi.[1]
Polarnost kemijske veze
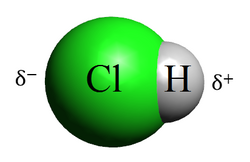
Kovalentna veza može biti polarna i nepolarna. Polarna kovalentna veza je ona čiji pripadajući elektroni nisu jednako podijeljeni između dva atoma jer ih jedan atom jače privlači nego drugi.[2] Kad se kovalentnom vezom vežu raznovrsni atomi, koji imaju različit afinitet prema elektronima, tada atom s većim afinitetom jače privuče zajednički elektronski par. Najjednostavniji primjer je veza između atoma klora i vodika u molekuli klorovodika:
- • atom klora jače privlači zajednički elektronski par: ( i označuju male električne naboje)
Time dolazi do asimetrične raspodjele negativnog naboja u vezi, čime jedan kraj veze postaje relativno negativno nabijen () a drugi relativno pozitivno nabijen (). U kovalentnim molekulama zbog razlika u elektronegativnosti atoma dolazi do spomenute nejednakomjerne raspodjele elektrona, odnosno do razdvajanja težišta pozitivnog i negativnog naboja te takva molekula ima dva pola pozitivni i negativni. To su polarne ili dipolne molekule odnosno skraćeno dipoli. Zato takva kovalentna veza ima djelomično ionsku prirodu. Znači, ako je razlika elektronegativnosti atoma u molekuli veća, elektronski par je bliže elektronegativnijem atomu i pritom je molekula jače polarna, stupanj ionske veze je veći.
Stupanj dipolnog karaktera kovalentne veze može se eksperimentalno odrediti mjerenjem jakosti dipola. Mjerenje se osniva na orijentaciji dipolnih molekula u električnom polju. Negativan pol molekule usmjeri se prema pozitivnom električnom polju a pozitivan pol molekule obrnuto. Jakost dipola izražavamo električnim dipolnim momentom (μ), koji je jednak umnošku naboja (e) i razmaka između težišta naboja (l):
Električni dipolni moment molekula Molekula HF HCl HBr HI / 10−30 Cm 6,41 3,62 2,60 1,27 % ionskog karaktera veze 44 18 12 5
Dipolni karakter molekula opada od HF do HI. Drugim riječima najveći djelomični ionski karakter veze ima molekula HF a najmanji HI. Kad bi veza između atoma klora i vodika bila čisto ionskog karaktera, onda bi molekula HCl imala dipolni moment:[3]
- gdje je naboj elektrona 1,60·10-19 C
Dipolni moment H2 je nula jer je veza nepolarna. Dipolni moment O−H veze dolazi od njene polarnosti i ima vrijednost 4,3·10−30 Cm, što je više od vrijednosti dipolnog momenta za Cl−H vezu, koja iznosi 3,62·10−30 Cm.
Sve što smo do sada rekli odnosi se jednako na kemijske veze kao i na molekule u cjelini, jer smo razmatrali dvoatomne molekule. Međutim dipolni moment neke kemijske veze je vektorska veličina i do dipolnog momenta složenijih molekula dolazimo vektorskim zbrajanjem.
Polarnost molekula i dipolni moment
Ukupni dipolni moment molekule može biti nula iako molekula sadrži polarne veze. To se događa ako su dipolni momenti pojedinačnih veza raspoređeni simetrično da se poništavaju. Četiri C−H dipolna momenta molekule metana razmještena su simetrično u tri dimenzije i geometrijski pravilno pod istim kutovima, tako da se dipolni momenti vektorskim zbrajanjem veličina poništavaju a rezultat je nula. Molekula metana je nepolarna.
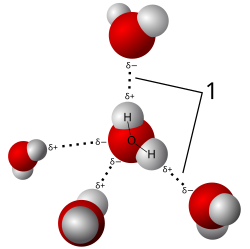
Molekula vode ima svoje dvije veze pod kutem od 105°, dva dipolna momenta O−H veza po 4,3·10−30 Cm, koji se ne poništavaju i zato je molekula polarna. Vektorskim zbrajanjem ova dva dipola daju rezultat od 6,14·10−30 Cm za molekulu kao dipol (vidi sliku).[4]
Polarnost i elektronegativnost
Prikladna mjera za težnju atoma da stvara polarne veze jest njegova elektronegativnost. Ona se obično označava s χ (grčko hi) a vrijednost joj je razmjerna aritmetičkoj sredini ionizacijske energije i elektronskog afiniteta atoma. Popis vrijednosti elektronegativnosti nekih atoma dat je u tabeli ispod:
Elektronegativnost nekih atoma, H: 2,20 Li: 0,98 Be: 1,57 B: 2,04 C: 2,55 N: 3,04 O: 3,44 F: 3,98 Na: 0,93 Mg: 1,31 Al: 1,61 Si: 1,90 P: 2,19 S:2,58 Cl: 3,16
Jače elektronegativan atom u kemijskoj vezi jače privlači zajedničke elektrone k sebi i stvara električno negativni kraj veze. Tipičan primjer su atomi halogenih elemenata, koji mogu također postati negativni anioni. Nasuprot tome manje elektronegativan atom će stvarati električno pozitivan kraj veze. Tipičan primjer su atomi alkalnih metala koji lako mogu postati pozitivni kationi.
Elektronegativnost nam pomaže predvidjeti stupanj polarnosti neke veze jednostavnom usporedbom elektronegativnosti atoma u toj vezi:
- C−H veza je slabo polarna
- O−H veza je znatno polarnija, što smo upoznali na primjeru vode [4]
Polarne tvari
- Polarnost je obilježje tvari čije molekule imaju stalni električni dipolni moment. Ona je posljedica građe molekula i razlike u elektronegativnosti povezanih elemenata.[5]
Dakle, polarnost molekula neke tvari bitno utječe na svojstva te tvari koja opažamo (talište, vrelište, agregatno stanje, tvrdoća, topljivost, kristalizacija...), kažemo da je tvar polarna.
Voda
Voda je tipična polarna tvar i ubrajamo je među najpolarnija otapala s stalnim električnim momentom koji iznosi 6,14·10−30 Cm. Voda kao tvar nije jednostavan skup molekula vode. Jer su molekule vode dipoli među molekulama vode djeluju elektrostatske privlačne sile, koje tom skupu molekula daju osobita svojstva od kojih sada razmatramo vodu kao otapalo. U vodi se dobro otapaju soli koje su ionske građe dok se ugljikovodici u vodi ne otapaju a sastavljeni su od nepolarnih molekula. Soli su ionske građe i kažemo da su soli primjer polarnih tvari. Otapanjem u vodi anioni i kationi iz soli se oslobađaju iz kristalne rešetke i mogu se gibati. Također zbog ion-dipolnog privlačenja ioni bivaju okruženi molekulama vode što nazivamo hidratacijom i nastaju hidratizirani ioni. Proces hidratacije je egzoterman što pospješuje otapanje soli. Zato pravilo otapanja glasi: "Tvari polarne građe otapaju se u polarnim otapalima." [6]
Molekule vode se međusobno privlače znatnim međumolekulskim silama koje nazivamo vodikova veza. Snaga vodikove veze je oko 5% snage kovalentne veze. Zbog polarnosti molekula i snage vodikove veze voda ima mnoga osobita svojstva:
- Procjenjuje se da je vrelište vode za oko 160 °C više od očekivanog
- Voda je tekućina s najvećom površinskom napetošću
- Voda ima među tekućinama vrlo visok specifični toplinski kapacitet
- Anomalija vode, led je manje gustoće od vode pri 4 °C
Ionske tvari
U ionske tvari ubrajamo razne soli, hidrokside, kiseline (uvjetno) i neke kompleksne spojeve jer su njihovi kristali građeni od iona. Topljivost tih tvari u vodi je dobra dok se iste slabo ili nikako ne otapaju u nepolarnim otapalima (benzen, benzin, tetraklormetan, eteri). Ionske tvari možemo smatrati izrazito polarnim tvarima; kada neka polarna kovalentna veza postane najpolarnija što je moguće (teorijski), zapravo imamo ionsku vezu.
Polarnost organskih spojeva
Polarnost organskih spojeva promatramo nešto drukčije jer su veličine i svojstva molekula drugačija. Pogledajmo to na primjeru alkohola, koji su brojna skupina spojeva s hidroksilnom funkcionalnom skupinom, −O−H.
| alkohol | metanol | etanol | propanol | butanol | pentanol | heksanol |
| formula | ||||||
| Topljivost (g/100 g vode, 20 °C) | potpuna | potpuna | potpuna | 7,9 | 2,4 | 0,6 |
Svi prikazani alkoholi imaju po jednu hidroksilnu skupinu −O−H, koja je polarna, s dipolnim momentom od 4,3·10−30 Cm, koji je kod svih alkohola gotovo jednak. Prva tri alkohola topljiva su u vodi u svim omjerima a to je svakako posljedica polarne −O−H veze. Naredna tri alkohola su slabo topljiva a sljedeći su praktično netopivi, što predstavlja veliku razliku u svojstvu topljivosti. Ovu pojavu možemo promatrati na dva načina:
- Što je duža molekula, duži je njen ugljikovodični dio koji je istovremeno hidrofoban i nepolaran, koji "bježi" od vode i topljivost pada.
- Što je duža molekula, polarna −O−H "glava" molekule je sve "razrjeđenija" već u samom alkoholu, njen upliv je sve manji i topljivost pada.[7]
Topljivost alkohola u vodi potvrđuje pravilo: "Slično se otapa u sličnom!"
Najpoznatije skupine organskih spojeva možemo razvrstati prema rastućoj polarnosti molekula što je povezano s njihovim funkcionalnim skupinama:
Izvori
- ↑ [1] Leksikografski zavod Miroslav Krleža, Hrvatska enciklopedija, mrežno izdanje: Polarnost
- ↑ [2] Generalić Eni, "Englesko-hrvatski kemijski rječnik & glosar: "Polarna molekula", 23 Feb. 2017. KTF-Split. 3 Apr. 2017.
- ↑ Filipović, Lipanović: "Opća i anorganska kemija", 9. izd., Školska knjiga, Zagreb, 1995., ISBN 953-0-30907-4, str.255-257
- ↑ 4,0 4,1 P. W. Atkins, M. J. Clugston: Načela fizikalne kemije, Školska knjiga, 4.izd, Zagreb, 1996., ISBN 953-0-30908-2, str. 41-43
- ↑ [3] Leksikografski zavod Miroslav Krleža, Proleksis enciklopedija, mrežno izdanje, ožujak 2017.: Polarnost
- ↑ Habuš, Strićević, Liber: Opća kemija 2, 2. izd., Profil, Zagreb, 2008., ISBN 978-953-12-0390-6, str. 30-35.
- ↑ D. Stričević, B. Sever: Organska kemija, Profil, 7. izdanje, 2004.g., ISBN 950-200-751-2 nevaljani ISBN, str. 63-64
- ↑ [4] University of Colorado at Boulder, Department of Chemistry and Biochemistry: Thin Layer Chromatography (TLC)














