Datiranje ugljikom-14
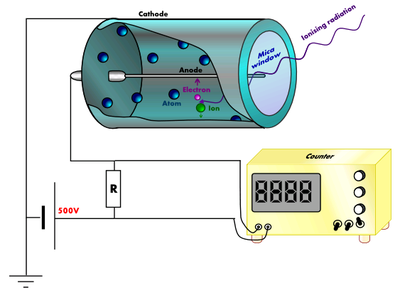
Datiranje ugljikom-14, radiougljično datiranje ili radiokarbonsko datiranje je određivanje starosti organskih tvari na temelju omjera broja atoma stabilnog ugljikova izotopa 12C i radioaktivnog izotopa 14C. Izotop 14C nastaje u visokim slojevima Zemljine atmosfere djelovanjem kozmičkih zraka na dušik (14N). On se, vezan u ugljikovu dioksidu (CO2), širi brzo i ravnomjerno cijelom biosferom. Njegova se količina u atmosferi nije mijenjala kroz dugo vremensko razdoblje; zapravo, bila je konstantna sve do 1950-ih, kada je testiranjem termonuklearnog oružja u velikim količinama bio proizveden i raspršen u okoliš. Iz atmosfere 14C prelazi izravno u biljke i neizravno, preko hranidbenoga lanca, u druge žive organizme. Zbog toga je u živim bićima omjer 12C i 14C konstantan. Kada se smrću prekine izmjena tvari između organizma i atmosfere, radioaktivni se raspad ne zaustavlja i organske tvar počinje gubiti 14C. Određivanjem preostalog 14C u nekom uzorku nežive tvari može se izračunati koliko je vremena prošlo od trenutka smrti. Vrijeme poluraspada ugljika 14C iznosi 5 730 godina; ustanovi li se, na primjer, da neki komad drveta ili drvenog ugljena sadrži upola manje ugljika 14C nego živo stablo, zaključuje se da je taj komad drveta ili ugljena star 5 730 godina, ako sadrži samo četvrtinu količine 14C koju je imao dok je drvo bilo živo, star je 11 460 godina. Geiger-Müllerovim brojilom mogu se odrediti i ekstremno male količine tog izotopa. U živom drvetu od jednoga bilijuna atoma ugljika samo je jedan radioaktivan, u jednom gramu svježeg uzorka ugljika dogodi se približno 13,5 raspada u minuti. Danas se može odrediti starost organskih tvari: pergamenta, odjeće, fosila, ljudskih i životinjskih kostiju i drugog, od 500 do 50 000 godina. Metoda se primjenjuje u arheologiji, antropologiji, geologiji, geofizici.[1]
Datiranje ugljikom-14 je razvio Willard Libby 1949. kao profesor na Sveučilištu u Chicagu. Za to je dobio Nobelovu nagradu za kemiju 1960.[2][3]
Fizikalne osnove
Postoje 3 prirodna izotopa na Zemlji: ugljik-12 je prisutan 99 %, ugljik-13 je prisutan 1 % i ugljik-14 je prisutan samo u tragovima (1 dio na 1x1012 dijelova ili 0,0000000001 %). Vrijeme poluraspada ugljika-14 je 5 730±40 godina. Raspada se u dušik-14 preko beta raspada. Aktivnost je oko 14 raspada u minuti i po gramu ugljika-14. Ugljik-14 se stvara u gornjim slojevima troposfere i u stratosferi, na visinama 9 do 15 km iznad površine Zemlje. Kada kozmičke zrake uđu u atmosferu, one uz ostalo stvaraju i neutrone, koji reagira s dušikom:
Ugljik-14 oksidira u 14CO2 i rasporeduje se po cijeloj atmosferi. Omjer koncentracija izotopa ugljika C-12 : C-13 : C-14 i iznosi 1012 : 1010 : 1. Od ovih izotopa jedino je ugljik-14 radioaktivan, pa se njegovi nuklidi raspadaju prema reakciji:
stvara se stabilni atom dušika-14, elektron i antineutrino. Nekoliko faktora utječe na točnost:
- proces izotopne izmjene, tj. frakcioniranje ugljikovih atoma
- varijacije koncentracije ugljika-14 u atmosferi u prošlosti
- zagađivanje uzoraka suvremenim ili starim ugljikom-14
Proračun starosti uzorka
Radioaktivni raspad izotopa ugljika-14 slijedi eksponencijalni raspad:
gdje je N - broj radioaktivnih atoma ugljika-14 i λ - je konstanta raspada (pozitivan broj). Kao rješenje ove jednadžbe, broj radioaktivnih atoma N se može napisati kao funkcija vremena:
- ,
Koja opisuje eksponencijalno raspadanje u vremenskom rasponu t, i kao početni uvjet je N0 – broj atoma ugljika-14 na početku raspadanja, kada je t=0
Dva relativna vremena se mogu definirati prema navedenome:
- srednji život – srednje vrijeme koje svaki radioaktivni atom provede u danom uzorku dok se ne raspadne
- = = ugljik-14 srednji ili prosječni život = 8033 godina (Libby vrijednost)
- poluživot – vrijeme koje je prošlo za pola broja radioaktivnih atoma da se raspadnu u danom uzorku
- = = ugljik-14 poluživot = 5568 godina (Libby vrijednost)
Slijedi za radioaktivni datum:
Dok za radioaktivno doba je:
Nakon zamjene vrijednosti, teoretsko radioaktivno doba, koristeći logaritam za prirodni broj e vrijedi sljedeća formula:
Ili koristeći logaritam za bazu 2 vrijeme poluživota:
Metode mjerenja

Općenito su u upotrebi tri osnovne tehnike mjerenja aktivnosti izotopa ugljika-14 u raznim materijalima: mjerenje plinskim proporcionalnim brojačem, tekućinskim scinitilacijskim brojačem, te akceleratorskom masenom spektroskopijom. Osnovna karakteristika svih ovih metoda je da su destruktivne, tj. uzorak čiju se starost želi odrediti treba spaliti i dalje pripremiti u obliku pogodnom za mjerenje aktivnosti ugljika-14.
Radiometrijske metode se zasnivaju na brojanju pojedinačnih raspada radioaktivnog izotopa ugljika-14. Potrebna količina ugljika ovisi o veličini i tipu brojača, ali nije manja od 5 g, s time da valja uzeti u obzir činjenicu da ugljik čini oko trećinu mase organskog materijala. Za datiranje kostiju treba uzeti daleko veću količinu uzorka, jer iz njih treba ekstrahirati organski dio (kolagen), čiji se udio smanjuje kod starih kostiju. Poseban problem radiometrijskih mjerenja predstavlja utjecaj zračenja okoline i kozmičkog zračenja, koji zasjenjuje detekciju radioaktivnog raspada atoma ugljika-14. Ovo, tzv. osnovno zračenje, valja reducirati što je više moguće primjenom tzv. pasivnih i aktivnih štitova. Pasivni štit se sastoji od velike količine olova koji reducira utjecaj kozmičkih zraka, odnosno parafina koji smanjuje utjecaj neutronskog zračenja. Radi smanjenja utjecaja kozmičkog zračenja, laboratoriji se obično smještaju u suterenske ili podrumske prostorije. Aktivni štit se sastoji od dodatnih detektora koji registriraju prolaz kozmičkog zračenja i koji rade u tzv. antikoincidentnoj tehnici. Ako oba detektora, onaj koji mjeri aktivnost ugljika-14 u uzorku i ovaj zaštitni, istovremeno detektiraju neki impuls, onda to znači da on potječe od osnovnog zračenja, a ne od raspada ugljika-14 atoma, pa se takovi impulsi odbacuju.
Plinski proporcionalni brojač
Plinski proporcionalni brojač (engl. GPC - gas proportional counter). Kod mjerenja ugljika-14 aktivnosti plinskim proporcionalnim brojačem, potrebno je određenim kemijskim postupcima dobiti neki plin koji sadrži sav ugljik iz uzorka, a istovremeno se može koristiti kao radni plin u brojaču. Ovisno o laboratoriju, kao brojački plin upotrebljavaju se ugljični dioksid, metan, acetilen ili benzen. Proporcionalni brojač se sastoji obično od cilindrične katode i anode u obliku tanke centralne žice. Između njih je razlika potencijala od nekoliko tisuća volti. Beta-čestice nastale raspadom ugljika koji je sastavni dio molekula brojačkog plina ioniziraju na svom putu molekule plina, ostavljajući za sobom trag koji se sastoji od pozitivnih iona i elektrona. Elektroni se ubrzavaju prema anodi i u njenoj blizini, gdje je električno polje najjače, proizvode lavine parova ion-elektron , koji se sakupljaju na anodi, proizvodeći električne impulse. Svaki beta raspad stvori jedan impuls i on se detektira elektroničkim putem.

Tekućinski scintilacijski brojač
Tekućinski scintilacijski brojač (engl. LSC - liquid scintillation counter). Za mjerenje tekućinskim scinitlacijskim brojačem uzorak se kemijskim postupcima pretvara u benzen, C6H6, koji je vrlo pogodan materijal, jer je 96% njegovog sastava ugljik. Scintilacijski detektori zasnivaju se na činjenici da čestice ionizacijskog zračenja, usporavajući se ili zaustavljajući se u određenim organskim spojevima, nazvanim scintilatorima, uzrokuju pulseve svjetlosnih fotona. Stoga se benzenu dodaje manja količina organskog scintilatora, kako bismo dobili scintilacijsku otopinu, tzv. koktel. Budući da je ugljika-14 sastavni dio uzorka, elektroni nastali beta raspadom ekscitiraju njegove molekule. Ekscitacijska energija se prenosi od jedne molekule do druge, sve dok je ne zarobi molekula scintilatora, prilikom čega se emitira svjetlo (foton). Broj emitiranih fotona proporcionalan je energiji ionizacije. Dobiveni svjetlosni fotoni se na fotokatodi pretvaraju u elektrone (Fotoelektrični učinak). Fotomultiplikator ubrzava primarne elektrone s foto-katode i pri tom se njihov broj umnožava. Na izlazu dobijemo snažan električni puls proporcionalan amplitudi svjetla (scintilacija), dakle energiji upadne čestice.
Akceleratorska masena spektroskopija
Akceleratorska masena spektroskopija (engl. AMS - accelerator mas spectrometry). Nasuprot radiometrijskim tehnikama, umjesto pojedinačnih raspada atoma ugljika-14, akceleratorska masena spektrometrija mjeri omjer atoma ugljika-14 izotopa u odnosu na najzastupljeniji izotop ugljika, ugljika-12. Kod ove tehnike na brojanje ne utječe kozmičko zračenje koje je glavni izvor smetnji kod plinskih i tekućinskih brojača. Akceleratorskom tehnikom se može odrediti starost daleko manje količine uzorka, sve do miligrama ili čak mikrograma (npr. zrno žita, komadić tkanine, dio lista papira), a granična starost koju se može dostići ovom metodom iznosi do 60 000 godina. Dodatne prednosti ove metode su kratko vrijeme mjerenja i manja pogreška, no ona je daleko skuplja i zahtijeva rad na skupim nuklearnim strojevima.
Uzorak se kemijskim putem prevodi u grafit, koji predstavlja metu koja se izlaže bombardiranju česticama iz akceleratora. Ionizirani atomi se zatim ubrzavaju u jakom električnom polju. Prolaskom kroz magnet razdvajaju se atomi mase 14 od atoma mase 12 i 13, nakon čega se u posebno konstruiranom detektoru određuje omjer C-14/C-12 za svaki uzorak.[7]
Umjeravanje
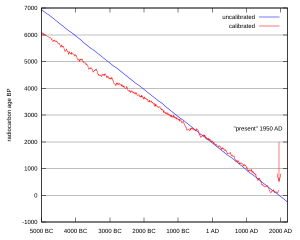
Starost mjerena metodom radioaktivnog ugljika temelji se na pretpostavci da je koncentracija aktivnosti ugljika-14 bila u prošlosti konstantna u prirodnim rezervoarima (prvenstveno atmosferi). Međutim, najviše uslijed flukutacija Sunčevog magnetskog polja (Sunčev ciklus), ona nije bila konstantna, te rezultati mjerenja ne odgovaraju točno pravoj starosti mjerenog materijala.[9] Zbog toga se ukazala potreba da se promjene u koncentraciji aktivnosti ugljika-14 u prošlosti odrede nekom nezavisnom metodom. Cikličke promjene godišnjih doba uzrokuju nepravilnosti u širini godova u drveću, a one su slične za sve drveće iste vrste u određenoj klimatskoj zoni. Slijed godova tvori vrstu kalendara. Spajanjem slijeda godova pojedinog starog drveća poznate starosti i mjerenjem ugljika-14 aktivnosti pojedinačnih godova bilo je moguće dobiti neprekinutu umjernu krivulju za proteklih 12 000 godina.
Produljenje umjerne krivulje na još veće starosti moguće je metodom brojanja varvi (godišnji sloj sedimentnih stijena), te datiranjem siga (stalaktiti, stalagmiti) ili sedri metodom torij-230/ uran-234/ uran-238.
Stvaranje ugljika-14 za vrijeme nuklearnih pokusa
Nadzemni nuklearni pokusi, koji su izvođeni u nekoliko država između 1955. i 1980. su znatno povećali količinu ugljika-14 u atmosferi i zatim u cijeloj biosferi. Nakon toga se količina ugljika-14 počela smanjivati.[10]
Izvori
- ↑ radioizotopno datiranje, [1] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2014.
- ↑ • Nepoznat parametar:
coauthors
• Nepoznat parametar:issue
• Parametarpmidnije dopušten u klasijournal
• Parametartypenije dopušten u klasijournal
• Parametarurlnije dopušten u klasijournal - ↑ • Nepoznat parametar:
archiveurl
• Nepoznat parametar:archivedate
• Nedostaje obavezni parametar:journal
• Parametartypenije dopušten u klasijournal
• Parametarurlnije dopušten u klasijournal
• Parametaraccessdatenije dopušten u klasijournal - ↑ • Nepoznat parametar:
archivedate
• Nepoznat parametar:archiveurl
• Parametartypenije dopušten u klasijournal
• Parametarpublishernije dopušten u klasijournal
• Parametarurlnije dopušten u klasijournal
• Parametaraccessdatenije dopušten u klasijournal - ↑ • Parametar
typenije dopušten u klasijournal
• Parametarurlnije dopušten u klasijournal - ↑ • Parametar
accessdatenije dopušten u klasiweb - ↑ • Nedostaje obavezni parametar:AMS instrument backgrounds|author=Taylor RE, Southon J|journal=Nuclear Instruments and Methods in Physics Research B|volume=259|pages=282–28|year=2007|doi=10.1016/j.nimb.2007.01.239
journal
• Parametartypenije dopušten u klasijournal - ↑ • Parametar
typenije dopušten u klasijournal
• Parametarurlnije dopušten u klasijournal - ↑ • Parametar
typenije dopušten u klasijournal - ↑ Citation | title = Discussion: Reporting and Calibration of Post-Bomb chem|14|C Data | year = 2004 | journal = Radiocarbon | pages = 1299–1304 | volume = 46 | issue = 3 | last1 = Reimer | first1 = Paula J. | last2 = Brown | first2 = Thomas A. | last3 = Reimer | first3 = Ron W.











