Etin
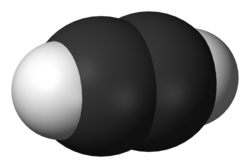
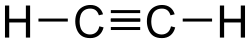
Etin (C2H2, staro ime acetilen; lat. acētum - ocat; stgrč. ὕλη - drvo, tvar je najjednostavniji alkin.
Osobine
Acetilen je najjednostavniji nezasićeni ugljikovodik s trostrukom vezom. Prvi je član homolognog reda alkina. Molekula etina je linearna, izgrađena od dva atoma vodika i dva atoma ugljika (C2H2).
Plin je lakši od zraka (1.171 kg/m3 pri 0 °C i 101,325 Pa), bez boje i okusa, ukapljuje se na -83.6 °C.
U čistom stanju ima slabi eteričan miris, a u nečistom stanju prodorni miris po češnjaku, jer se dobiva iz kalcijevog karbida tehničke čistoće koji je onečišćen fosfidima i drugim spojevima.
U vodi se slabo otapa, a u organskim otapalima dobro.
Zbog opasnosti, u acetilen se dodaju neki spojevi neugodna mirisa tako da se može osjetiti na vrijeme.
Pod povišenim tlakom eksplozivno reagira sam sa sobom, a s nekim metalima i njihovim spojevima (bakar, srebro, živa) stvara vrlo eksplozivne spojeve.
Etin može reagirati s jakim bazama kao kiselina, odnosno zamijeniti vodikov atom s metalom, čime nastaju etinidi (acetilidi). Primjer je reakcija između etina i Tollensovog reagensa, čime nastaje srebrov etinid (srebrov acetilid):
Etinidi teških metala vrlo su osjetljivi eksplozivi. Eksplozijom se raspadaju na elemente.
Difuzni plamen u zraku mu je svijetao i čađav, a u struji kisika gori blještavo na temperaturi do 3100 °C zbog čega se koristi u uređajima za autogeno zavarivanje i rezanje čelika i ostalih metala visokog tališta.
Komercijalno nabavljiv etin dolazi otopljen u acetonu pod tlakom od 12 do 15 bara, u čeličnim bocama napunjenim šupljikavom masom (u prošlosti azbestom), pod imenom disu-plin, prema franc. acetylene dissous.
Kataliziranom reakcijom etina i vode, uz pomoć katalizatora kao što je živin(II) sulfat, nastaje etanal (acetaldehid) koji se može oksidirati u octenu kiselinu ili reducirati u etanol.
Adicijom klorovodika etin daje vinil-klorid, adicijom octene kiseline vinil-acetat, a adicijom klora tetrakloretan.
Njemački kemičar Walter Julius Reppe pronašao je nove metode preradbe etina u važne međuproizvode organske sinteze.
Dobivanje
Danas se pripravlja u industriji i u laboratoriju djelovanjem vode na kalcijev karbid (CaC2):
Uporaba
Zbog svijetlog plamena, bio je korišten za osvjetljenje (tzv. karbidne lampe).
U kemijskoj tehnici etin je osnovna tvar za proizvodnju velikog broja važnih kemijskih proizvoda: boja, lijekova, otapala, polimernih materijala, umjetnih kaučuka, itd.
Kratko se koristio u smjesi s kisikom koristio za narkozu, no praksa je napuštena zbog izuzetne eksplozivnosti smjese, te loših postanestetskih svojstava (mučnina i glavobolja).
Izvori
- Hrvatska enciklopedija (LZMK), Broj 1 (A-Bd), str. 314.. Za izdavača: Leksikografski zavod Miroslav Krleža, Zagreb 1999.g. ISBN 953-6036-31-2
![{\displaystyle \mathrm {C_{2}H_{2}+2\ [Ag(NH_{3})_{2}]^{+}+2\ NO_{3}^{-}\longrightarrow Ag_{2}C_{2}\ +2\ NH_{4}NO_{3}+2\ NH_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/1bb510bbaf9863c30ad68c46400777ff5003e25c)
