Atomska jezgra


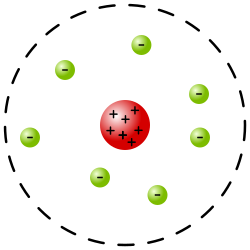

Atomska jezgra ili jezgra atoma nalazi se u središtu atoma i čini 99,9% njegove mase, a zauzima samo oko 10–14 volumena (obujma) atoma. Na primjer kada bi atom bio kugla promjera 6 kilometara, atomska jezgra bi bila veličine teniske loptice. Svi sastavni dijelovi u atomu u neprestanu su gibanju. Jezgra se sastoji od električki pozitivno nabijenih protona i neutralnih neutrona. Promjer atomske jezgre je od 1,75 · 10–15 metara (vodikova jezgra) do 15 · 10–15 metara (uranijeva jezgra). Protoni i neutroni su u jezgri stopljeni zajedno djelovanjem privlačne nuklearne, odnosno jake sile. Protoni i neutroni sastavljeni su od triju još manjih čestica, kvarkova. [1]
Ukupni naboj same jezgre je pozitivan i ovisi o broju protona. U periodnom sustavu elemenata atomi su poredani upravo po broju protona u jezgri, odnosno atomskom broju koji je naznačen u lijevom donjem indeksu (na primjer 1H). Zbroj masa protona i neutrona naziva se relativna atomska masa, izražen je u jedinici unificirane atomske mase u i naznačen je u lijevom gornjem indeksu (na primjer 1,008H), dok se zbroj protona i neutrona naziva maseni (nukleonski) broj, a označava se sa A.
Osnovne veličine
Atomski broj
Atomski broj (oznaka Z) je broj protona u atomskoj jezgri, određuje svojstva atoma.
Neutronski broj
Neutronski broj (oznaka N) je broj neutrona u atomskoj jezgri. Može biti različit u jezgrama istoga kemijskog elementa (takve se jezgre nazivaju izotopnima).
Maseni broj
Maseni broj (oznaka A) je ukupan broj protona i neutrona (nukleona) u atomskoj jezgri.
Defekt mase
Defekt mase je razlika između zbroja masa slobodnih nukleona od kojih se jezgra sastoji i mase jezgre, odgovara ekvivalentnoj energiji vezanja nukleona.
Energija vezanja po nukleonu
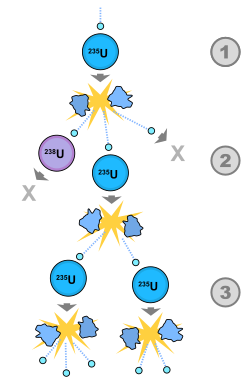
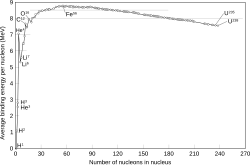
Energija vezanja po nukleonu razlikuje se od jezgre do jezgre i određuje krivulju stabilnosti ovisno o masenome broju elementa (prema energiji vezanja po nukleonu mogu se predvidjeti fuzijski procesi na malim vrijednostima i fisijski na velikim vrijednostima masenoga broja). Energija Sunčeva zračenja oslobađa se u efektivnoj pretvorbi četiriju protona u jezgru helija (fuzijom kilograma vodika u nešto manje od kilograma helija oslobađa se energija od 6 · 1014 J).
Konstanta raspada
Konstanta raspada opisuje brzinu raspadanja atomskih jezgara ili subatomskih čestica u nekom uzorku radioaktivne tvari.
Vrijeme poluraspada
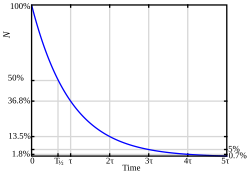
Vrijeme poluraspada je vrijeme potrebno da se raspadne polovica nestabilnih atomskih jezgara ili subatomskih čestica u nekom uzorku radioaktivne tvari.
Modeli atomske jezgre
Model kapljice
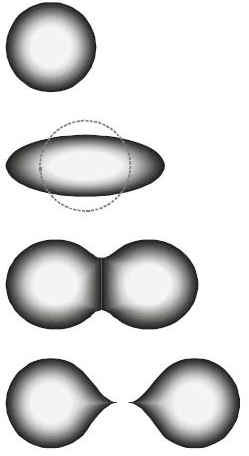
Model kapljice opisuje atomsku jezgru kao kap nestlačivoga nuklearnoga fluida velike gustoće. Predložio ga je G. Gamow (1931.), a razvio N. Bohr. Analogan je modelu kapljice tekućine koju čine molekule. Stabilnost atomske jezgre ovisi o obliku kapi, a energija proizlazi od površinske napetosti i električnog odbijanja među protonima. Model objašnjava kuglasti oblik većine jezgri i pomaže predvidjeti energiju nuklearnog vezivanja. Tako su H. A. Bethe i C. F. von Weizsäcker na temelju modela kapljice tekućine (1935) izračunali energiju vezanja nukleona i objasnili nuklearnu fuziju atomskih jezgri u zvijezdama.
Model ljusaka
Model ljusaka opisuje jezgru atoma kao da je izgrađena od međusobno neovisnih ljusaka protona i neutrona djelomično analognih ljuskama koje opisuju raspored elektrona u atomu. Razvila ga je M. Goeppert-Mayer (1949.). Stabilnost jezgre ovisi o broju nukleona, a najstabilnije su jezgre punih ljusaka koje imaju magični broj protona i neutrona. One su i sferno simetrične. Nuklearna deformacija u modelu ljusaka je odstupanje jezgre od sferične ili osne simetrije; povezana je s kolektivnim gibanjima nukleona. Ona dovodi do pobuđenja valentnih nukleona, ali i do dinamičkih deformacija (vibracija) te statičkih deformacija (rotacija). Za razvoj modela deformiranih jezgri zaslužni su G. Alaga te A. N. Bohr, B. R. Mottelson i J. Rainwater.
Kromodinamički model
Kromodinamički model atomske jezgre u kvantnoj kromodinamici je nakupina nukleona povezanih jakom nuklearnom silom zaostalom od jakog međudjelovanja među kvarkovima unutar pojedinih nukleona. Jaka nuklearna sila ne ovisi o električnome naboju nukleona, to jest iste je jakosti između bilo koja dva nukleona (protona i protona, neutrona i neutrona ili protona i neutrona). [2]
Atomska teorija
U atomskoj teoriji materije, atom se sastoji od atomske jezgre oko koje kruže elektroni. Danas je općenito priznato mišljenje da se atomska jezgra svih kemijskih elemenata sastoji od pozitivno nabijenih protona i neutrona koji nemaju električni naboj. Čestice koje se nalaze u atomskoj jezgri, to jest protoni i neutroni, zovu se zajedničkim imenom nukleoni (lat. nucleus: jezgra). Neutron ima masu gotovo jednaku masi protona. Proton je jezgra vodikovog atoma, pa mu je masa jednaka masi atoma vodika. Broj protona u atomskoj jezgri koji se zove atomski broj, jednak je njezinom električnom naboju i uvijek odgovara rednom broju kemijskog elementa u periodnom sustavu. Dakle atomskim brojem određena je vrsta kemijskog elementa.
U neutralnom atomu broj elektrona što kruže oko jezgre jednak je broju protona u jezgri. Pozitivan naboj jednog protona jednako je velik kao negativan naboj elektrona. 1869. ruski kemičar D. I. Mendeljejev otkrio je zakonitost ponavljanja kemijskih svojstva elemenata kod povećanja njihove atomske mase. On je tada sve poznate elemente poredao po rastućim atomskim masama jedan iznad drugoga i sastavio periodičku tablicu. Mendeljejev je dokazao da svaki kemijski element ima određen sastav atoma koji označuje atomska masa i mjesto u periodnom sustavu elemenata.
Broj protona P i neutrona N u jezgri određuje atomsku masu A određenog elementa, to jest:
i zove se maseni broj atoma. Na primjer jezgra helija sastoji se od dva protona i dva neutrona. Prema tome je električni naboj jezgre i redni broj helija 2, a relativna atomska masa 4. Oko atomske jezgre kruže negativno nabijeni elektroni, a broj elektrona jednak je broju protona u jezgri.
No kod istog broja protona u jezgri mogu postojati različite količine neutrona. Dva atoma koji imaju isti broj protona, a različiti broj neutrona, imaju skoro ista kemijska svojstva i isti redni broj, ali različite atomske mase. Takvi se elementi koji imaju isti redni broj, a različitu atomsku masu, zovu izotopi. Tako na primjer postoji klor koji ima redni broj 17, to jest njegova jezgra sadrži 17 protona, dok mu je atomska masa 35, što znači da jezgra njegova atoma sadrži 18 neutrona (17 + 18 = 35). Međutim, postoji i klor s atomskom masom 37, to jest jezgra njegova atoma sadrži 20 neutrona (17 + 20 = 37). Običan klor koji se nalazi u spojevima u prirodi ima atomsku masu 35,46, što znači da je on smjesa tih dvaju izotopa koji su u njemu zastupani u omjeru 3 : 1, to jest:
Prvi izotop klora pišemo simbolički 17Cl35, a drugi 17Cl37. Gornji broj uz kemijski simbol elementa znači relativnu atomsku masu tog elementa, a donji - broj protona u jezgri tog elementa, odnosno njegov redni broj. I vodik ima svoje izotope: 1H1 obični vodik, 1H2 teški vodik ili deuterij i 1H3 tricij.
Ovakvi izotopi nađeni su gotovo kod svih kemijskih elemenata. Tako uranij, koji je najvažniji u dobivanju nuklearne energije, ima 5 izotopa. Uranij ima redni broj 92, a njegovi izotopi imaju atomske mase 234, 235, 237, 238 i 239. U prirodnom uraniju najjače je zastupljen izotop s atomskom masom 238. Ima ga 137 puta više nego izotopa s atomskom masom 235. Ostalih njegovih izotopa ima još i manje. Izotopi se danas vrlo mnogo primjenjuju u medicini, tehnici i privredi, a naročito su veoma važni u proizvodnji nuklearne energije. Odjeljivanje izotopa vrši se centrifugiranjem, destilacijom, difuzijom i tako dalje.
Da se jezgra atoma koja se sastoji od pozitivno nabijenih protona ne razleti, jer se istoimeni električni naboji međusobno odbijaju, uzrok su privlačne sile koje vladaju, između protona i neutrona. To su takozvane sile jezgre ili osnovne sile koje, iako su vrlo velike, djeluju samo na vrlo male daljine, to jest u dimenzijama atomske jezgre. Tumačenje tih sila spada danas u glavne probleme atomske fizike. [3]
Sastav atomskih jezgara
Iskustvena potvrda Rutherfordove jednadžbe, učvrstila je pretpostavku da između alfa-čestica i atomskih jezgara vladaju poznate Coulombove sile. Na osnovu toga može se proračunati kako blizu jezgri dopre alfa-čestica koja se otklanja pod određenim kutom. Čestice vrlo velikih brzina mogu doći sasvim blizu tako da je ispitana Coulombova sila sve do udaljenosti 10-14 metara. Dođu li izvanredno brze alfa-čestice još na veću blizinu atomskoj jezgri, slika sa pokusa ne proizlazi više iz odbojnog Coulombova potencijala. Između alfa-čestica i jegri javljaju se nove sile, koje znatno prevladavaju Coulombov električni potencijal. Po Rutherfordu možemo kao polumjer atomske jezgre odrediti onu udaljenost kod koje prestaje između alfa-čestica i atomske jezgre vrijediti Coulombova odbojna sila. Taj polumjer iznosi za najteže atomske jezgre oko 10-14 metara.
Bez obzira na to kakve su sile između atomskih jezgara na velikim i malim udaljenostima, osnovno načelo mehanike: zakon o održanju impulsa i energije, moraju vrijediti za sve srazove. Predočimo sebi alfa-česticu, koja udari o neku drugu atomsku jezgru. Prije sraza ima alfa-čestica impuls sile m1∙v, gdje je m1 masa alfa-čestice, a v njena brzina prije sraza. Kad udari u atomsku jezgru, prenosi dio svojeg impulsa i poprima impuls m1∙v’. Po zakonu o održanju impulsa mora impuls alfa-čestice prije sraza biti jednak zbroju impulsa obiju čestica poslije sraza:
Ovu vektorsku jednadžbu možemo pisati u komponentama u smjeru osi y i x:
Od prvobitnog smjera otklonjena je alfa-čestica za kut θ1, a jezgra za kut θ2. Prva nam je jednadžba sistema kaže da je prvobitni impuls alfa-čestice jednak zbroju impulsa obiju čestica u prvobitnom smjeru. Druga jednadžba kaže da se impulsi obiju čestica, okomiti na prvobitni smjer, poništavaju.
Prema zakonu o održanju energije mora kinetička energija alfa-čestica prije sraza biti jednaka zbroju kinetičkih energija obiju čestica poslije sraza:
Srazove između alfa-čestica i jezgri možemo motriti u Wilsonovoj komori. Alfa-čestice poznate brzine dolaze do radioaktivne tvari i prolaze kroz plin komore. Tad se često opazi da se staza neke alfa-čestice savije, a od mjesta pregiba odleti druga čestica. Brzine obiju čestica mogu se izmjeriti, a isto tako i kutovi njihovih staza s prvobitnim smjerom. Unesu li se vrijednosti iz pokusa za v’, v”, θ1 i θ2 u jednadžbu impulsa i energije, uvijek se nalazi da su jednadžbe ispunjene. Zakoni o održanju impulsa i energije vrijede strogo za sve srazove.
Brzine čestica nakon sraza dadu se mjeriti pomoću savijanja u magnetskom polju ili iz duljine i debljine staze. Ali one se mogu i ukloniti iz zadnje dvije jednadžbe. Tad nam preostaje još jedna jednadžba, u kojoj dolaze mase čestica i kutovi otklona:
Iz te jednadžbe može se prema izmjerenim kutovima θ1 i θ2 izračunati masa udarene jezgre. Ta je metoda vrlo prikladna da se ustanovi koja je atomska jezgra u Wilsonovoj komori zadobila udarac.
Često je najzgodnije da se promatraju središnji srazovi. Tad alfa-čestica i jezgra lete u prvobitnom smjeru. U gornjim jednadžbama moramo staviti θ1 = 0 i θ2 = 0. Iz zakona o održanju impulsa i energije:
možemo isključivanjem odmah izračunati brzinu koju dobiva atomska jezgra pri srazu:
Na primjer kod udarca alfa- čestice na proton (atom vodika) dobivamo:
To znači da je brzina protona 60% veća od prvobitne brzine alfa-čestice. No središnje udareni protoni imaju najveću brzinu. Ta najveća brzina može se mjeriti i prema mjerenjima je zaista 1,6 puta veća od početne brzine alfa-čestice. Zadnja jednadžba omogućuje nam da, mjereći najveće brzine udarenih atomskih jezgri, izračunamo njihove mase. To je jedna od najboljih metoda da se utvrde nepoznate atomske jezgre u Wilsonovoj komori.
Nuklearna reakcija
Pri točnijem ispitivanju prolaza alfa-čestica kroz Wilsonovu komoru bili su ipak otkriveni i protoni s mnogo većim brzinama nego što bi to odgovaralo središnjem srazu. Paradoks se objasnio kad je Rutherford opazio da ti brzi protoni dolaze i onda kad alfa-čestice prolaze kroz tvari u kojima nema vodika. Rutherford je pustio alfa-čestice kroz čisti dušikov plin i na veliko iznenađenje opazio da se od alfa-čestica odvaja staza jednog protona. Rutherford je odmah ispravno protumačio da se tu događa pretvorba atomskih jezgara, alfa-čestica prodre u dušikovu jezgru, a jedan proton biva izbačen. Kemijskim simbolima možemo tu reakciju pisati:
Gornji indeksi označuju masu atomskih jezgri, a donji njihov naboj ili redni broj elementa. Primitkom jedne alfa-čestice i gubitkom jednog protona povećava se masa dušikove jezgre za 3, a naboj za 1, pa iz dušika dobivamo kisikov izotop s atomskom težinom 17.
Sad je bilo jasno, zašto se javljaju i protoni većih energija nego što bismo ih dobili središnjim srazom alfa-čestica. Višak energije protona potječe od energije atomske jezgre. Reakcije atomskih jezgri mogu teći s dobitkom ili gubitkom energije, a tu razliku u energijama nose izbačene čestice. Pretvorbe atomskih jezgri iznijele su na vidjelo da su protoni sastavni dijelovi svih atomskih jezgri. No vidi se odmah da pored njih moraju u izgradnji jezgri sudjelovati i druge čestice. Dva protona dala bi doduše naboj helijeve jezgre, ali ta jezgra ima 4 puta veću masu od protona. No koje su još čestice pored protona u atomskim jezgrama?
W. Bothe i Herbert Becker su 1930. opazili da pri obasjavanju lakih elemenata alfa-česticama nastaje neko vrlo prodorno zračenje. Malo kasnije našli su I. Joliot-Curie i F. Joliot-Curie da nove zrake bivaju jako apsorbirane u tvarima koje obiluju vodikom. Iz tih tvari nove zrake izbijaju protone s brzinama oko desetine brzine svjetlosti. Kakva je priroda tih zraka? Chadwick je malo kasnije ispitivao djelovanje zraka u Wilsonovoj komori. Zagonetne zrake nisu se vidjele u Wilsonovoj komori - znak da ne nose električni naboj. No opet to nisu mogle biti ni gama zrake. U Wilsonovoj komori vidi se kako lake jezgre, kao protoni, helijeve, litijeve, berilijeve i ugljikove jezgre, zadobivaju snažne udarce, što se ne može objasniti djelovanjem elektromagnetskih valova. J. Chadwick je objasnio ova opažanja hipotezom o novoj vrsti čestica - neutronima. Te čestice nemaju električnog naboja pa ne ioniziraju i ne vide se u Wilsonovoj komori. Brzinu i masu nevidljivih čestica možemo proračunati tako da motrimo najveće brzine udarenih atoma. Chadwick je mjerio najveće brzine udarenih protona i dušikovih atoma. Za omjer najvećih brzina protona i dušikovih jezgri dobiva se prema:
gdje je: x - masa neutrona. Najveće brzine udarenih protona su oko 7 puta veće od najvećih brzina dušikovih atoma. Za masu neutrona dobiva se odatle vrijednost 1. Neutroni, dakle, imaju otprilike istu masu kao i protoni. Time se direktno objašnjava zašto nove zrake izbacuju snažno protone iz tvari bogatih vodikom. Kao kod sraza biljarskih kugli, tako i tu mogu neutroni najjače pokrenuti jednako teške protone.
Iste godine kad je otkriven neutron, postavili su D. D. Ivanjenko i W. Heisenberg hipotezu, da su atomske jezgre građene od protona i neutrona. Ova hipoteza održala se i kasnije i temelj je čitave nuklearne fizike. Pri razbijanju jezgara nalazimo uvijek protone, neutrone ili lake jezgre, a nikada ne elektrone i pozitrone.
Vidjeli smo da su atomske težine približno cijeli brojevi. Zaokružene relativne atomske težine, kao čiste cijele brojeve bez fizičke dimenzije, označit ćemo sa A. Atomska težina A pokazuje ukupan broj sastavnih dijelova jezgre, a redni broj Z daje broj protona. Svaka atomska jezgra određena je s ta dva podatka: A i Z. Nađene su, ipak, i različite atomske jezgre s istim A i Z, ali po svemu se čini da se tu radi o dva različita kvantna stanja iste jezgre. Mi ćemo odsad pretpostaviti da atomska težina i redni broj jednoznačno opisuju vrstu atomske jezgre. Atomske jezgre s jednakim brojem protona, a različitom masom, zovemo izotopima. Atomske jezgre s jednakim brojem čestica zovu se izobare.
Atomskih jezgara ima mnogo više od kemijskih elemenata, jer neki kemijski elementi imaju i preko 10 različitih izotopa. Može se grafički dobiti lijep pregled nad svim jezgrama tako da pojedine jezgre nanesemo kao točke u križaljku, kod koje apscisa određuje broj protona, a ordinata broj neutrona. Iz položaja jezgre u tablici može se odmah razabrati od koliko je protona i neutrona građena. Izvučena dijagonala na tablici označuje one jezgre kod kojih je broj protona jednak broju neutrona. Ispod dijagonale broj je protona veći od broja neutrona, a iznad dijagonale preteže broj neutrona u jezgri.
Već kratki pregled nad poznatim jezgrama odmah pokazuje da u prirodi nisu ostvarene sve moguće kombinacije između protona i neutrona. Kod jezgri je broj protona približno jednak broju neutrona. Kod lakih jezgri vrijedi ovaj zakon vrlo točno. Najčešće jezgre u prirodi, kao helij 2He4, ugljik 6C12, dušik 7N14, kisik 8O16, magnezij 12Mg24, silicij 14Si28, sumpor 16S32, kalcij 20Ca40, građene su od jednakog broja protona i neutrona. Dolaze i izotopi tih jezgri, kod kojih je ta simetrija između protona i neutrona za jednu ili dvije ili tri čestice narušena, ali se ipak sve te jezgre gomilaju oko dijagonale kod koje je broj protona jednak broju neutrona. Ta približno ostvarena simetrija između broja neutrona i protona jedan je od temeljnih zakona fizike jezgre, i mi ćemo morati tražiti razlog te simetrije. Kod težih jezgri prevladava sve više broj neutrona nad brojem protona. Suvišak neutrona nad protonima iznosi kod teških jezgri po više desetaka. "Rijeka" jezgri završava s uranijem, koji ima električni naboj 92 i masu 238. Broj neutrona kod te jezgre jednak je razlici između mase i naboja, dakle 238 - 92 = 146. Suvišak neutrona nad protonima iznosi kod toga glavnog uranijevog izotopa 54. Simetrija je tu već znatno narušena. [4]
Izvori
- ↑ atom, [1] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2019.
- ↑ nuklearna fizika, [2] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2019.
- ↑ Velimir Kruz: "Tehnička fizika za tehničke škole", "Školska knjiga" Zagreb, 1969.
- ↑ Ivan Supek: "Nova fizika", Školska knjiga Zagreb, 1966.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||










