Parcijalni tlak
Parcijalni tlak u smjesi idealnih plinova u nekom spremniku, je tlak koji bi plin imao kada bi sam zauzimao isti spremnik. Ukupan tlak smjese plinova je zbroj pojedinih parcijalnih tlakova svih komponenti u smjesi. [1]
Parcijalni tlak plina otopljenog u tekućini je jednak parcijalnom tlaku plina, koji bi on stvorio u plinskom obliku, u ravnoteži sa tekućinom, jednake temperature. Parcijalni tlak nekog plina je mjera termodinamičke aktivnosti plinskih molekula. Plinovi će uvijek ići iz područja višeg parcijalnog tlaka u niži, i što je veća razlika, protok će biti veći. Plinovi koje se miješaju će djelovati prema njihovim parcijalnim tlakovima.
Daltonov zakon parcijalnih tlakova
Daltonov zakon govori o tlakovima pojedinih vrsta plinova u smjesi plinova, a glasi: tlak smjese jednak je zbroju parcijalnih tlakova plinova koji čine smjesu. Parcijalni tlak određenog plina u smjesi, je onaj tlak koji bi taj plin imao kada bi sam zauzimao obujam, koji zauzima smjesa. [2]
Na primjer, ako imamo smjesu idealnih plinova dušika (N2),vodika (H2) i amonijaka (NH3):
| gdje je: | |
| - ukupan tlak smjese plinova | |
| - parcijalni tlak dušika (N2) | |
| - parcijalni tlak vodika (H2) | |
| - parcijalni tlak amonijaka (NH3) |
Idealna smjesa plinova
U smjesi idealnih plinova, parcijalni tlakovi se odnose kao i broj različitih molekula. Molni udio pojedinog plina se može izraziti kao i njevog parcijalni tlak: [3]
pa se parcijalni tlak pojedine komponente može izraziti kao:
| gdje je: | |
| - molni udio pojedinog plina u smjesi plinova | |
| - parcijalni tlak pojedinog plina u smjesi plinova | |
| - broj molova pojedinog plina u smjesi plinova | |
| - ukupan broj molova u smjesi plinova | |
| - ukupan tlak smjese plinova |
Tlak pare
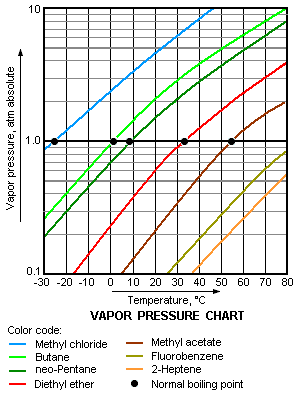
Tlak pare je tlak čestica u plinovitom stanju koje se nalaze iznad površine tvari u krutom ili tekućem stanju. Ovaj pojam se koristi najviše za opisivanje težnje tekućine da hlapi. To je ustvari mjera težnje molekula ili atoma da pobjegnu iz tekućine ili krute tvari. U zatvorenom sustavu čestice koje isparavaju ne mogu napustiti prostor iznad površine. Zato se počinju vraćati natrag u tekućinu te je nakon nekog vremena broj čestica koje isparavaju i onih koje se vraćaju jednak. To je stanje dinamičke ravnoteže, a tlak pare u tim uvjetima zove se ravnotežni tlak pare. Ravnotežni tlak pare je pri konstantnoj temperaturi karakterističan za svaku tekućinu. Zagrijavanjem tekućine u otvorenom sustavu tlak pare se povećava sve dok se ne izjednači s atmosferskim tlakom. Vrelište tekućine pod atmosferski tlakom odgovara temperaturi kada je tlak pare jednak okolnom atmosferskom tlaku i često se naziva normalno vrelište. [4]
Što je viši tlak pare tekućine kod neke temperature, to je normalno vrelište tekućine niže. Na primjer, propan ima najviši tlak pare od svih plinova iz dijagrama, a ima i najniže normalno vrelište (-43,7 °C). To se može vidjeti iz sjecišta linije propan (ljubičasta linija) sa linijom koja prikazuje tlak od 1 atm.
Parcijalni tlakovi u plinovima za ronjenje
Kod ronilačke opreme udio nekog pojedinog plina za ronjenje se izražava sa parcijalnim tlakovima. Parcijalni tlak se može izračunati:
- parcijalni tlak = ukupan apsolutni tlak smjese x udio obujma pojedine komponente
Za neki plin "i" vrijedi:
- ppi = P x Fi
Na primjer, na 50 metara dubine, apsolutni tlak je 6 bara (600 kPa) = 1 bar atmosferskog tlaka + 5 bara tlaka vode, i parcijalni tlakovi najvažnijih komponenti zraka, kisika ima 21% obujma i dušika 79% obujma, su:
- ppN2 = 6 bar x 0,79 = 4,7 bar absolute
- ppO2 = 6 bar x 0,21 = 1,3 bar absolute
Minimalna donja granica za parcijalni tlak kisika u smjesi plinova je 0,16 bara (16 kPa) apsolutnog tlaka. Hipoksija i iznenadni gubitak svijesti postaje problem kada je za parcijalni tlak kisika manji od 0,16 bara. Otrovnost kisika, koja je povezana sa grčenjem, postaje problem kada je parcijalni tlak previsok. Američka organizacija NOAA (engl. National Oceanic and Atmospheric Administration) preporučuje maksimalno izlaganje od 45 minuta – ako je parcijalni tlak kisika 1,6 bara (apsolutni tlak), 120 minuta kod parcijalnog tlaka kisika 1,5 bara, 150 minuta kod parcijalnog tlaka kisika 1,4 bara, 180 minuta kod parcijalnog tlaka kisika 1,3 bara i 210 minuta kod parcijalnog tlaka kisika 1,2 bara.
Narkoza dušikom je problem kada je plin za disanje pod visokim pritiskom. Normalno, najveći parcijalni tlak za dušik je 4,5 bara i maksimalna dubina ronjenja 35 metara.











