Gibbsova slobodna energija
Gibbsova slobodna energija, Gibbsova energija, Gibbsov potencijal ili slobodna entalpija (oznaka G) je fizikalna veličina koja opisuje oslobođenu ili apsorbiranu energiju u nekom povratnom (reverzibilnom) procesu koji se odvija pri stalnoj temperaturi T i tlaku p. Definirana je kao entalpija H umanjena za umnožak entropije S i temperature T:
ili
gdje je: V - volumen, a U - unutarnja energija termodinamičkog sustava. Pri minimalnoj promjeni Gibbsove energije (ΔG = 0), uz stalnu temperaturu i tlak, sustav je u kemijskoj ravnoteži. U spontanim se procesima Gibbsova energija smanjuje (ΔG < 0), a entropija se povećava. Promjena je Gibbsove energije pozitivna (ΔG > 0) samo onda kada se u sustav dovodi energija. Mjerna jedinica Gibbsove energije jest džul (J). Nazvana je po J. W. Gibbsu. [1]
Objašnjenje
Gibbsova slobodna energija (G) jest energija oslobođena ili apsorbirana u povratnom ili reverzibilnom procesu pri konstantnoj temperaturi i tlaku.[2] Definirana je jednadžbom:
gdje je: ΔG - promjena Gibbsove energije, ΔH - promjena entalpije, T - termodinamička temperatura i ΔS - promjena entropije. Jednadžba zapisana s reakcijskim veličinama glasi:
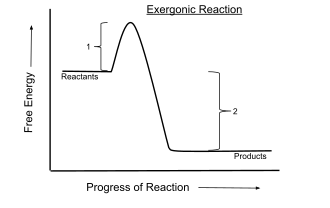
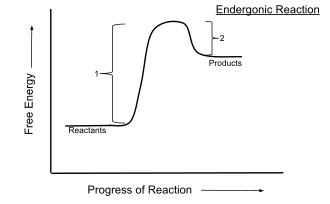
Biokemijske reakcije se uglavnom odigravaju pri konstantnom tlaku i temperaturi. Za te uvjete predznak Gibbsove energije predstavlja osnovni kriterij za određivanje spontanosti reakcije. Tako kod spontanih ili egzergonih reakcija vrijedi da se one ireverzibilno odvijaju prema postizanju stanja ravnoteže kojeg karakterizira minimum Gibbsove energije te za njih vrijedi ΔrG<0, dakle odvijaju se uz smanjenje Gibbsove energije. Kod nespontanih ili endergonih reakcija dolazi do povećanja Gibbsove energije, ΔrG>0 i one se mogu odvijati spontano u suprotnom smjeru, ako su reverzibilne.
Kako bi se razumjela Gibbsova slobodna energija, najbolje ju je tumačiti kroz jednadžbu:
koja predstavlja ukupnu energiju reakcije koja može imati pozitivni predznak, ako je za odvijanje reakcije potrebno uložiti energiju, pa sustav veže energiju (reakcija je endotermna) i negativni predznak ako se prilikom odvijanja reakcije energija oslobodila na primjer u obliku topline (reakcija je egzotermna). ΔrG u toj jednadžbi predstavlja energiju koja se može pretvoriti u fizikalni rad pa se Gibbsova energija najjednostavnije može definirati kao ona slobodna energija nastala reakcijom koja se može iskoristiti za obavljanje nekog rada. TΔrS predstavlja energiju koja se ne može iskoristiti za obavljanje rada (degradirana energija).[3]
To možemo pojasniti na primjeru egzotermne reakcije:
- H2 (g) + 1/2 O2 (g) → H2O (l) za koju vrijede standardne veličine:
Ta je reakcija egzotermna što znači da se njenim odvijanjem po molu oslobodi 285,8 kJ energije, no ta se energija ne može sva iskoristiti za obavljanje rada što znači da ΔrG≠W≠ΔrH gdje je W rad. Razlog tome je to što tom reakcijom dolazi do povećanja uređenosti sistema, to jest dolazi do smanjenja entropije jer iz više čestica, koje stvaraju veći nered, nastaje molekula vode što znači da se neuređenost sistema smanjila. No, drugi zakon termodinamike kaže - da bi se reakcija odvijala spontano uvijek treba doći do porasta ukupne entropije koja je jednaka zbroju promjena entropija okoline i sistema:
Budući da je došlo do pada entropije u sistemu, dio topline/energije, koji je nastao reakcijom,mora se prenijeti na okolinu kako bi u njoj došlo do povećanja entropije, te je time zadovoljen zakon da je uvijek ΔSukup > 0.
Od oslobođenih 285,8 kJ/mol okolini se za povećanje entropije preda 44,7 kJ/mol što znači da je ostalo 237,1 kJ/mol slobodne energije koja se može iskoristiti za rad i upravo tu slobodnu energiju nazivamo Gibbsovom slobodnom energijom.
Izvori
- ↑ Gibbsova energija (Gibbsov potencijal, slobodna entalpija), [1] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2017.
- ↑ ''Gibbsova slobodna energija'' Kemijski rječnik, pristupljeno 30. kolovoza 2014.
- ↑ Vladimir Hankonyi, Vladimir Ondrušek ''Izabrana poglavlja fizikalne kemije'', Zagreb, 1990., str. 29.





