Građa materije
Najsitniji djelići tvari zovu se molekule , a sastavljene su iz različitih kombinacija atoma. Atomi su najsitnije čestice od kojih su sastavljeni čisti kemijski elementi. Po pojednostavljenom, tzv. Bohr-ovom modelu, atomi se sastoje od pozitivno nabijene atomske jezgre oko koje kruže negativno nabijeni elektroni. Jezgra sadrži pozitivno nabijene protone i električki neutralne neutrone, koji su nositelji mase.
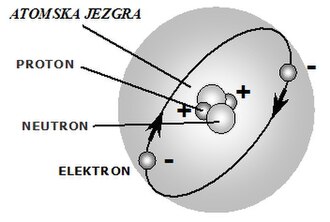
Elektroni oko atomske jezgre kruže brzinom svjetlosti, tj. toliko brzo, da se skoro istodobno nalaze na svim mjestima kuglaste staze koja obavija jezgru, tvoreći na taj način takozvanu "ljusku" elektrona. Teški elementi imaju veliki broj elektrona koji kruže u nekoliko (najviše sedam) koncentričnih kuglastih staza, odnosno imaju nekoliko koncentričnih elektronskih "ljuski". Mogući broj elektrona u pojedinim elekronskim ljuskama određen je izrazom , pri čemu je n redni broj elektronske ljuske u atomu. Tako primjerice u prvoj ljuski atom može imati najviše dva elektrona, a u trećoj = 18. Za ljuske koje sadrže maksimalno mogući broj elektrona, kažemo da su "popunjene".


Istoimeno nabijene čestice se međusobno odbijaju, slično kao što se među sobom odbijaju istoimeni polovi magneta. Suprotno tome, različito nabijene čestice međusobno se privlače, slično kao što sjeverni magnetski pol snažno privlači južni. Pozitivno nabijena atomska jezgra stoga privlači negativne elektrone savladavajući centrifugalnu silu uslijed njihovog kruženja u elektronskoj ljuski, tako da se atom drži na okupu. Atom je normalno električki neutralan, tj. pozitivan naboj jezgre uravnotežen je s negativnim nabojima njegovih elektrona.
U nekim tvarima, elektroni su tako čvrsto vezani u atomima, da se nikada ne odvajaju od jezgre i uvijek ostaju kružiti po svojim kuglastim stazama. Takve tvari poznajemo kao izolatore, tj. materijale koji ne provode električnu struju. To su u pravilu tvari s popunjenim elektronskim ljuskama u atomima.
Za razliku od takvih, u drugim tvarima neki su elektroni relativno labavo vezani u atomu, tj., elektroni iz djelomično popunjenih vanjskih ljuski relativno lako mogu "iskočiti" iz svojih normalnih kuglastih staza i "uskočiti" u eventualno prazno mjesto u ljuskastoj stazi susjednog atoma. Na taj način, labavo vezani elektroni mogu se kretati po tvari, preskačući s atoma na atom. Takve materijale poznajemo kao vodljive ili električne vodiče, a spomenuti labavo vezani elektroni zovu se slobodni elektroni. Atomi kojima nedostaju elektroni u elektronskim ljuskama u cjelini su pozitivno nabijeni, jer im je broj protona u jezgri veći od broja elektrona. Zovemo ih ioni-ma Stupanj sposobnosti materijala za vođenje struje, odnosno za propuštanje slabo vezanih elektrona zove se vodljivost. Pojednostavljeno, možemo uzeti da tvari koje imaju više slabo vezanih elektrona imaju bolju vodljivost, pa pružaju manji otpor prolasku struje kroz tvar. Dobra vodljivost, u načelu je karakteristika metala, međutim i metali se među sobom znatno razlikuju po vodljivosti električne struje.
Atomi ne stoje mirno u strukturi materijala, nego titraju oko svog ravnotežnog položaja. Titranje je to snažnije, što je viša temperatura tvari. Teoretski, atomi se potpuno smiruju samo kod najniže teoretski moguće temperature (tzv. apsolutna nula, tj. 0 stupnjeva po Kelvinovoj skali temperature), koja iznosi oko - 273 °C . Približno tako niska temperatura u prirodi postoji samo u dubokom svemiru. Budući da su pri ekstremno niskim temperaturama atmi zbog odsutnosti titranja međusobno "stisnuti", pri niskim temperaturama je olakšano preskakanje slobodnih elektrona s atoma na atom, pa se time može objasniti porast vodljivosti vodiča sa sniženjem temperature. Neki materijali kod vrlo niskih temperatura postaju takozvani supravodiči, tj. pokazuju posebno malen otpor prolasku električne struje.


