Chapmanov ozonski ciklus
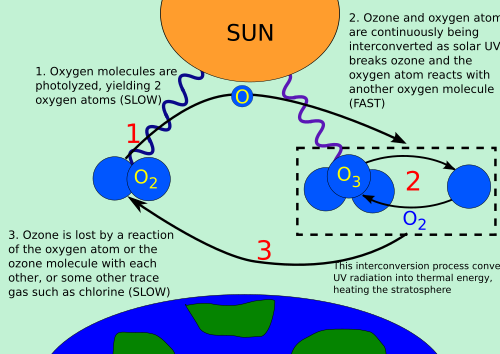
Chapmanov ozonski ciklus je postupak kojim se ozon stalno obnavlja u Zemljinoj stratosferi, pretvarajući Sunčevo ultraljubičasto zračenje u toplinu. 1930. engleski meteorolog Sydney Chapman je riješio taj kemijski postupak.
Kemija
Ozon u stratosferi nastaje uglavnom djelovanjem ultraljubičastog zračenja sa Sunca, koje reagira sa dvoatomnim kisikom O2:
- O3 + foton (UV zračenje < 240 nm) → O2 + O
Jednoatomni kisik odmah reagira sa dvoatomnim kisikom da stvori ozon:
- O2 + O + M → O3 + M
Molekule ozona koje su stvorene na taj način, upijaju ultraljubičasto zračenje sa Sunca valnih duljina između 240 i 310 nm, razbijajući triatomsku molekulu ozona u dvoatomnu molekulu kisika i jedan slobodni atom kisika:
- O3 + (240 nm < UV zračenje < 310 nm) → 2 O2 + O
Slobodni atom kisika odmah reagira sa dvoatomnom molekulom kisika da stvori ozon:
- O + O2 + M → O3 + M
Gdje je “M” katalizator koji prenosi višak energije iz kemijske reakcije. Na taj način, kemijska energija koja se oslobađa kada O i O2 reagiraju, pretvara se u kinetičku energiju molekularnog kretanja. Cijeli ciklus omogućuje pretvaranje UV zračenja sa Sunca u toplinu, bez gubitka ozona. Ovaj ciklus omogućuje ravnotežu ozonskog omotača, koji štiti Zemlju od UV zračenja (UVB i UVC), štetnog za većinu živih bića. To je i jedan od glavnih izvora topline u stratosferi, koja je toplija od gornjih slojeva troposfere.
Osiromašenje ozonskog omotača
Ako se susretnu molekula ozona i atom kisika, oni u kemijskoj reakciji stvaraju dvije molekule dvoatomnog kisika:
O3 + O· → 2 O2
Ako se susretnu dva atoma kisika, oni stvaraju molekulu dvoatomnog kisika:
2 O· → O2
Količina ozona u stratosferi je određena ravnotežom između stvaranja ozona Sunčevim zračenjem i razbijanja molekula ozona. Razbijanje molekula ozona je spor proces, budući je koncentracija atoma kisika vrlo rijetka.
Neki slobodni radikali, kao što su hidroksil (OH), dušikov monoksid (NO), atomi klora (Cl) i broma (Br), djeluju kao katalizatori u kemijskim reakcijama ozona, stvarajući ozonski sloj tanjim i stvarajući ozonske rupe, što se ne bi dešavalo da nema tih katalizatora.
Većina OH i NO je prirodno prisutno u stratosferi, dok ljudske aktivnosti stvaraju povećanu koncentraciju Cl i Br, posebno ispuštanjem klorofluorovodika (freoni) i halona. Svaki atom Cl ili Br, može razbiti i preko 10 000 molekula ozona, prije nego što nestane iz stratosfere.
Izvori
- [1] "Stratospheric Ozone", An Electronic Textbook