
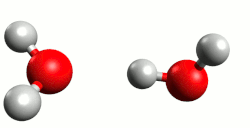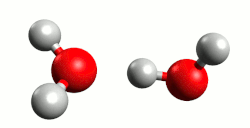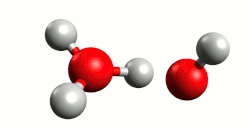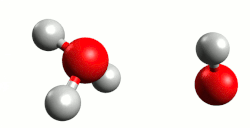







- Kiselina je molekula ili druga vrsta čestice koja može predati proton ili primiti elektronski par u kemijskoj reakciji.[1]
Iskustveno, kiseline su tvari koje u vodenoj otopini imaju kiseo okus, mijenjaju boju indikatora (npr. lakmusa od modre u crvenu). U reakciji s mnogim metalima oslobađaju vodik, a u reakciji neutralizacije s bazama stvaraju soli.
Elektrolitska disocijacija kiselina
Kiseline su najčešće kovalentni spojevi koji sadrže jedan ili više atoma vodika. U vodenoj otopini kiselina (proton donor) reakcijom elektrolitske disocijacije otpušta vodik kao proton (H+) koji se veže na molekulu vode (proton akceptor), dakle elektrolitska disocijacija je istovremeno reakcija kiseline s otapalom (vodom). Pri tome nastaje hidronijev (oksonijev) kation, H3O+. Primjeri s klorovodičnom (kloridnom) i dušićnom (nitratnom) kiselinom:
Cijepanje veze u molekuli kiseline koja sadrži vodikov atom i prijelaz protona na molekulu vode omogućeno je upravo nastajanjem stabilnog hidronijeva kationa (H3O+) što također znači da proton nije u otopini slobodan. Naime proton H+ je nestabilan u vodenoj otopini, ne može postojati sam te se stabilizira vezanjem na slobodni elektronski par molekule vode. Kiseline imaju kisela svojstva zbog hidronijeva kationa, koji je dakle nositelj kiselih svojstava kiselina. Zaključujemo da jakost neke kiseline ovisi o koncentraciji hidronijevih kationa.
Što dakle uvjetuje da li će neka kiselina biti jaka ili slaba? To ovisi o jakosti O−H veze u molekuli kiseline. Pogledajmo primjere dušične, sumporne i fosforne kiseline:
Cijepaju se veze O−H a ne veze N−O, S−O, P−O, zbog veće razlike u elektronegativnosti O i H atoma. Time također nastaju kiselinski anioni: NO3 -, HSO4- i H2PO4-. Kod dva posljednja iona još postoje O−H veze i mogućnost odcjepljenja protona ali ioni su već negativni te je mogućnost narednog odcjepljenja sve manja. Stupanj disocijacije, odnosno jakost kiseline ovisi o jakosti O−H veze, što je ta veza slabija kiselina je jača. Jakost veze ovisi o gustoći elektronskog oblaka oko kisikova atoma s kojim je povezan vodikov atom. Ta gustoća je to manja i također jakost veze s vodikom što je centralni atom veće elektronegativnosti i što je na njega vezano više „slobodnih” elektronegativnih atoma kisika, pa je prema njima koncentriran elektronski oblak molekule. Zato jakost kiseline pada u nizu:
nadalje u nizu:
Treba uočiti da kiselina može biti kationska, anionska ili električki neutralna. Općenito vrijedi, ako je elektronegativnost centralnog atoma molekule kiseline veća od 1,7 proton se oslobađa disocijacijom inače se oslobađa ion OH-.
Ako je veza između centralnog atoma i kisikova atoma približno iste polarnosti kao veza O−H mogu se cijepati sad jedna sad druga veza te nastaju npr. ioni:[2]

Takvo svojstvo tvari da se prema uvjetima mogu ponašati kao kiseline ili kao baze naziva se amfoternost.
Svojstvo amfoternosti pokazuje i voda:
Jakost kiselina
Jakost kiseline određena je stupnjem njezine disocijacije u otopini; kiselina je to jača što je više njezinih molekula disocirano a pH je manji. Jake kiseline u vodenim su otopinama potpuno disocirane, slabe i vrlo slabe su djelomično disocirane. Stupanj disocijacije neke kiseline može se matematički ovako izraziti:
Mjera jakosti neke kiseline je njena konstanta disocijacije, Ka. Primjer reakcija disocijacije klorovodične kiseline:
Pojednostavnjeno:
Konstanta disocijacije:
Uglate zagrade predstavljaju množinsku koncentraciju pojedine čestice u otopini kiseline. U nazivniku razlomka ne pojavljuje se [H2O] jer je koncentracija vode u odnosu prema koncentraciji kiseline u većini slučajeva velika te je [H2O] uključena u konstantu disociijacije.
Neke kiseline imaju više atoma vodika i mogu disocirati u više stupnjeva npr. sumporasta kiselina:
- prva konstanta disocijacije:
- druga konstanta disocijacije:
Drugi (i treći) stupanj disocijacije je uvijek puno slabiji.
Podjela kiselina prema jakosti
Prema konstanti disocijacije kiseline možemo podijeliti u grupe:
| Jakost kiseline | Konstanta disocijacije, Ka | Primjer kiseline |
|---|---|---|
| vrlo slabe kiseline | < 10−7 | H2S |
| slabe kiseline | 10−7 - 10−2 | H2CO3 |
| jake kiseline | 10−2 - 103 | H2S04 |
| vrlo jake kiseline | > 103 | HNO3 |
pH vrijednost
Praktično se kiselost izražava brojčano u pH vrijednostima. pH je mjera kiselosti ili bazičnosti vodenih otopina. Jednaka je negativnom logaritmu koncentracije iona vodika u otopini. Iskazuje se ljestvicom pH-vrijednosti od 0 do 14, pri čemu neutralne otopine (kao voda) imaju pH-vrijednost 7. Kisele otopine imaju pH ispod 7, a alkalične (bazične, lužnate) iznad 7. Kiseline su jače što je pH manji, a baze što je pH veći. pH vrijednost se mjeri indikatorima (lakmus papiri) ili pehametrom. S. P. Sørensen uveo je pH-ljestvicu 1909.[3]
Primjeri kiselina i konstante disocijacije
| Naziv kiseline | Kemijska formula | Ka1 | Ka2 | Ka3 |
|---|---|---|---|---|
| Benzojeva | C6H5COOH | 6,14·10−5 | ||
| Borna | H3BO3 | 5,83·10−10 | ||
| Cijanovodična | HCN | 2,1·10−9 | ||
| Fluorovodična | HF | 7,2·10−4 | ||
| Fosforna | H3PO4 | 7,11·10−3 | 6,34·10−8 | 4,2·10−13 |
| Hipoklorna | HOCl | 3,0·10−8 | ||
| Jodna | HIO3 | 1,7·10−1 | ||
| Limunska | HOOC(OH)C(CH2COOH)2 | 7,45·10−4 | 7,73·10−5 | |
| Mliječna | CH3CHOHCOOH | 1,37·10−4 | ||
| Mravlja | HCOOH | 1,77·10−4 | ||
| Octena | CH3COOH | 1,75·10−5 | ||
| Oksalna | HOOCCOOH | 5,36·10−2 | 5,42·10−5 | |
| Sumporna | H2SO4 | jaka | 1,2·10−2 | |
| Sumporasta | H2SO3 | 1,72·10−2 | 6,43·10−8 | |
| Sumpororvodična | H2S | 5,7·10−8 | 1,2·10−15 | |
| Ugljična | H2CO3 | 4,45·10−7 | 4,7·10−11 | |
| Trikloroctena | Cl3CCOOH | 1,29·10−1 | [4] |
Povijest definicija kiselina
Prvu korisnu definiciju kiselina dao je Justus Freiherr von Liebig 1838.:
- Kiseline su kemijski spojevi koji sadrže vodikove atome zamjenljive atomima metala.[5]
Arrheniusova elektrolitska disocijacija
- Kiseline su tvari koje elektrolitskom disocijacijom u vodenim otopinama daju hidronijev ion, H3O+.
Razumijevanje kiselina započinje teorijom elektrolitske disocijacije [[Tomas Ostwald|Wilhelma Ostwalda]] i Svante Augusta Arrheniusa iz 1880. Teorija se temelji na svojstvu nekih tvari, koje su nazvane elektroliti, da u vodenim otopinama tvore ione, električno nabijene čestice. Kiseline su spojevi koji sadrže vodik i u vodenim otopinama povećavaju koncentraciju vodikovih iona (H+, protona). Također je utvrđena veza između jakosti kiselina i koncentracije vodikovih iona (H+, protona). Istovremeno se bazična ili lužnata svojstva tvari mogu pripisati prisutnosti hidroksidnih iona (OH-) u vodenim otopinama. Tako se reakcija neutralizacije kiselina i baza može objasniti reakcijom ta dva iona koji daju neutralnu molekulu vode:
Kemičari su počeli temeljem te teorije kvantitativno računati konstante disocijacije kiselina i baza, što odgovara njihovoj „jačini”. Teorija nije mogla objasniti sve pojave u svezi kiselina i baza ali se održala narednih tridesetak godina.[6]
Kiseline i baze Bronsted-Lowry
Novu općenitiju definiciju predložili su 1923. godine gotovo istovremeno J.M. Bronsted i T.M. Lowry:
„Kiseline su tvari čije jedinke (čestice) mogu predati proton a baze su tvari čije jedinke mogu primiti proton.”
Teorija podrazumijeva ne samo proton kao vodikov kation u otopinama već i proton izvan otopina. Također kiselina ili baza mogu biti ioni. Definicija se simbolično može ovako prikazati:
kiselina ⇄ konjugirana baza + proton
A ⇄ e- + H+
Iz teorije proizlazi:
- svojstvo kiseline je neovisno o otapalu
- kiseline mogu biti kiselinski ioni onih kiselina koje imaju više H atoma (protona)
- molekule kao NH3 ili organski amini su baze jer imaju sklonost prijema protona
- neke molekulske vrste mogu biti i kiseline i baze ovisno o uvjetima, one su amfoterne, kao voda: H2O + H2O ⇄ H3O+ + OH-
- svaka kiselina ima svoju konjugiranu bazu, svaka baza ima svoju konjugiranu kiselinu: A1+ B2 ⇄ B1 + A2 [6]
Lewisove kiseline
Još općenitiju teoriju postavio je Gilbert N. Lewis 1923:
„Kiselina je tvar čije čestice mogu primiti par elektrona od baze uz nastanak kemijske veze koja se sastoji od jednog zajedničkog elektronskog para (kovalentna veza).” [6]
Time su objašnjeni slučajevi koje Bronstedt-Lowryjeva teorija nije mogla pojasniti. Reakcijom Lewisove kiseline s bazom nastaje adukt (produkt spajanja čestica) u kojem su dvije vrste povezane kovalentnom vezom a zajednički elektronski par daje baza. Lewisova kiselina ne mora sadržavati proton. Ako su Lewisova kiselina i baza nenabijeni, dobivena veza je dijelom polarna kao u reakciji bor trifluorida s amonijakom:
Često jedna ili obje vrste nose naboj (najčešće je pozitivni naboj na kiselini a negativni naboj na bazi) a položaj naboja unutar adukta često ovisi o teorijskom tumačenju valencija.
Primjeri su:
Izvori
- ↑ [1] Oxford Living Dictionaries: Acid
- ↑ Filipović, Lipanović: "Opća i anorganska kemija", 9. izd., Školska knjiga, Zagreb, 1995., ISBN 953-0-30907-4, str.411-414
- ↑ [2] Leksikografski zavod Miroslav Krleža, Proleksis enciklopedija: pH
- ↑ D. A. Skoog, D. M. West, F. J. Holler: Osnove analitičke kemije, Školska knjiga, Zagreb 1999., 1.izdanje, ISBN 953-0-30919-8
- ↑ [3] Leksikografski zavod Miroslav Krleža, Hrvatska enciklopedija: Kiseline
- ↑ 6,0 6,1 6,2 [4] ENCYCLOPÆDIA BRITANNICA, Ronald Percy Bell: Acid-base reaction










![{\displaystyle \qquad \mathrm {K_{a}={\frac {[H^{+}][Cl^{-}]}{[HCl]}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/40384dace58aec45ef65c358193ccab95f96a291)

![{\displaystyle \quad K_{a1}=\mathrm {\frac {[H_{3}O^{+}]\cdot [HSO{_{3}}{^{-}}]}{[H_{2}SO_{3}]}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/b021e99d4668452c638fcc11915846258fabe6c6)

![{\displaystyle \quad K_{a2}=\mathrm {\frac {[H_{3}O^{+}]\cdot [SO{_{3}}^{2-}]}{[HSO{_{3}}^{-}]}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/655e9c3aea6f58dfccd1429ecc2374e927b0e161)


![{\displaystyle \mathrm {Ag55\%2NH_{3}\leftrightarrows [Ag(NH-3)_{2}]^{+}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/4ec656a848e518047abe15ba53b1b2495445b1e3)
![{\displaystyle \mathrm {Cd^{2+}+4CN^{-}\leftrightarrows [Ce(CN)_{3}]^{2-}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f7a38a4de9dea31ce428baa0f0514bfdc9075fce)