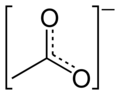
Acetat
Acetat je sol octene kiseline. Octena kiselina (-{SN3SOON}-) je supstanca topiva u vodi, koja stupa u reakcije s mnogim molekulama.
Acetati se u rastvoru drugačije ponašaju u odnosu na kiselinu od koje potječu. Oni u velikom broju slučajeva posredstvom hidrolize, a utjecajem jačeg metalnog iona, poprimaju bazne osobine. Molekule su nestabilne i dešava se da, tijekom vremena, određena količina acetata prijeđe u drugi oblik, a to prati oslobađanje kiseline, čiji se miris osjeća pri otvaranju posude u kojoj se ta supstanca nalazi. U strukturnom pogledu, kiselina spada u monokarboksilne kiseline i na karboksilnu grupu je vezana samo jedna metil grupa, koja ima značajan utjecaj na reaktivnost čitave molekule. Elektronegativniji kisik ima induktivni efekt privlačenja elektrona sa susjednog ugljika karboksilne grupe. Samim tim, bogati se elektronima kisik, a osiromašuje ugljik, koji ipak mora to nadoknaditi privlačenjem elektrona, ali znatno slabijim, sa susjedne metil grupe. Struktura acetatnog iona je također značajna za reaktivnost molekula koji ga sadrži. Кombinacija različitih tipova hibridizacije odigrava značajnu ulogu. Metil grupa je -{sp}-3 hibridizirana, a hibridizacija karboksilne grupe je -{sp}-2. Ovakva kombinacija omogućava karakterističnu prostornu orijentaciju i različitost u kutovima veza, što pojedine atome iona štiti, a druge navodi na reakciju.
Sama octena kiselina spada u slabe kiseline, pa najlakše reagira sa jakim bazama kao što su -{NaOH}- (natrij hidroksid, živa soda) i -{КOH}- (kalij hidroksid), gradeći odgovarajuću sol (natrij ili kalij acetat), pri čemu se izdvaja voda. Pri ovoj reakciji nisu potrebni katalizatori jer se reakcija lako odvija.Script error: The function "harvard_citation_no_bracket" does not exist.
-{CH3–CH2COOH + NaOH → CH3-CH2COONa + H2O}-
Voda nastaje reakcijom -{H+}- iona iz -{COOH}- grupe i -{ON-}- grupe iz natrij hidroksida. Natrij acetat se izdvaja pri ovoj reakciji kao beo talog na dnu epruvete. Octena kiselina s nekom od svojih soli sa alkalnim metalima gradi vrlo stabilne pufere koji se koriste radi postizanja određene -{pH}- vrijednosti. Acetati kao soli jakih baza i octene kiseline reagiraju bazno u procesu hidrolize. Postoje slučajevi kada acetati ne reagiraju bazno, već neutralno i to približno kod -{SN3COONH4}-, gdje su oba iona slaba i imaju slične proizvode rastvorljivosti u vodi. Acetati nisu soli octene kiseline samo sa neorganskim bazama. Postoje i organski spojevi koja su samo zbog svoje organske prirode nazvana esteri, a koja nastaju reakcijom esterifikacije u kojoj sudjeluje kiselina i alkohol, u prisustvu najčešće koncentrirane sumporne kiseline. Dolazi do stvaranja estera karakterističnih osobina. Postoji nekoliko ogleda koji pokazuju prirodu acetata. Odmjeri se približno ista količina natrij-acetata i vode i to se pomiješa, zagrijava do ključanja, a potom hladi naglo pod mlazom hladne vode. U tako ohlađenom rastvoru pri dodavanju nekoliko kristala iste soli, dolazi do burne i jasno vidljive kristalizacije. Gradi i toksične spojeve, a poznat je olovni šećer.
Struktura
-
Prostor-popunjavajući model acetatskog aniona -
Kugla-i-štap model aniona acetata -
Rezonansni hibrid acetatskog aniona -
Kanonski oblici acetatnog aniona
Izovri
ref