Rudolf Clausius
| Rudolf Clausius | |
 | |
| Rođenje | 2. siječnja 1822. Koszalin, Poljska |
|---|---|
| Smrt | 24. kolovoza 1888. Bonn, Njemačka |
| Državljanstvo | Nijemac |
| Polje | Fizika |
| Poznat po | Drugi zakon termodinamike Kinetička teorija plinova Uveo pojam entropija Clausiusov zakon |
| Istaknute nagrade | Copleyeva medalja (1879.) |
Rudolf Clausius ili punim imenom Rudolf Julius Emanuel Clausius (Koszalin u Poljskoj, nekad Köslin u Kraljevini Pruskoj, 2. siječnja 1822. - Bonn, 24. kolovoza 1888.), njemački teorijski fizičar. Profesor u Berlinu, Zürichu, Würzburgu i Bonnu. Jedan od utemeljitelja termodinamike i kinetičke teorije plinova. Isprva radio na matematičkoj teoriji elastičnosti. Produbivši ideje N. L. S. Carnota i É. Clapeyrona (Clausius-Clapeyronova jednadžba), razvio je termodinamiku kao egzaktnu znanost. Formulirao (1850.) drugi zakon termodinamike: "Toplina ne može prijeći s hladnijega na toplije tijelo bez drugih promjena u sustavu". Proučavanjem termodinamičkih procesa (na primjer Clausius-Rankineov proces) otkrio entropiju, razvio kinetičku teoriju topline, pronašao da je specifična toplina idealnoga plina konstantna (Clausiusov zakon). Dao pretpostavku da molekule u elektrolizi neprekidno izmjenjuju atome, a nju je S. A. Arrhenius razvio u svoju teoriju elektrolitičke disocijacije. [1]
Po njemu se zove i jedan krater na mjesecu: Clausius.
Clausius-Rankineov proces
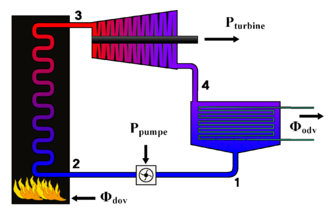
Clausius-Rankineov proces (ili samo Rankineov ciklus) je kružni proces (nazvan po R. J. E. Clausiusu i W. J. M. Rankineu) u kojem se iz toplinske energije dobiva mehanička energija, pri čemu kao radni medij služi para, ponajprije vodena para. U tehnici se taj proces ostvaruje u termoenergetskom postrojenju (termoelektrane) kombinacijom sljedeće osnovne opreme:
- parnim strojem ili parnom turbinom, gdje se dio toplinske energije priveden pari pretvara u mehaničku energiju, koja se može iskoristiti izravno, na primjer za pogon brodskog vijka, ili se u generatoru električne struje može pretvoriti u električnu energiju;
- parnim kondenzatorom, u kojem se para ukapljuje odvođenjem topline, najčešće s pomoću rashladne vode; napojnom pumpom, kojom se kondenzat ponovno vraća u generator pare. [2]
Clausius-Clapeyronova jednadžba
Clausius-Clapeyronova jednadžba (po Rudolfu Clausiusu i Émileu Clapeyronu) je jedna od temeljnih termodinamičkih jednadžbi koja opisuje izotermne fazne prijelaze 1. vrste (na primjer taljenje ili isparavanje). Ako je dp/dT gradijent krivulje promjene stanja, ΔH latentna entalpija promjene stanja, V1 i V2 odgovarajući volumeni dviju faza a T termodinamička temperatura na kojoj se promjena zbiva, jednadžba glasi: [3]
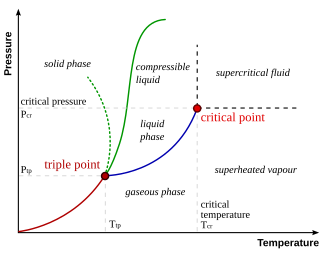
Fazni prijelazi
Fazni prijelazi su promjene stanja pojedine faze (elementarne, spoja, eutektičke smjese, peritektičkog spoja i slično) pri promjeni temperature. Razlikuju se:
- fazni prijelazi I. vrste, kod kojih su u stanju ravnoteže slobodne entalpije u obje faze jednake po vrijednosti, ali se pritom entropija i volumen skokovito mijenjaju. U fazne prijelaze I. vrste spadaju na primjer taljenje, isparavanje i sublimacija,
- fazni prijelazi II. vrste, kod kojih se u stanju ravnoteže ne mijenjaju ni entalpija, ni entropija, ni volumen. U fazne prijelaze II. vrste prijelazi kod kojih na primjer tvari gube feromagnetička svojstva, pojava supravodljivosti, procesi razlaganja i stvaranja međumetalnih spojeva u čvrstoj fazi i tako dalje [4]
Izvori
- ↑ Clausius, Rudolf Julius Emanuel, [1] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2015.
- ↑ Clausius-Rankineov proces, [2] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2015.
- ↑ Clausius-Clapeyronova jednadžba, [3] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2015.
- ↑ fazni prijelazi, [4] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2015.
