Vodikov peroksid
| Vodikov peroksid | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
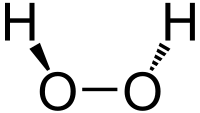 | ||||||||||||||
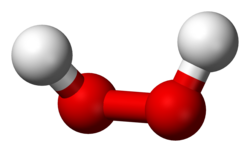 Strukturna formula vodikova peroksida
| ||||||||||||||
| IUPAC nomenklatura | vodikov peroksid | |||||||||||||
| Ostala imena | Dioksidan Oksidanil | |||||||||||||
| Identifikacijski brojevi | ||||||||||||||
| Osnovna svojstva | ||||||||||||||
| Molarna masa | 34,0147 g/mol | |||||||||||||
| Relativna molekulska masa | 34,0147 g/mol | |||||||||||||
| Izgled | Vrlo svjetlo plave boje; bezbojan u otopini, oštar miris | |||||||||||||
| Gustoća |
1.11 g/cm3 (20 °C, 30% (w/w) otop.)[1] | |||||||||||||
| Talište | 272,72 K -0,43 °C | |||||||||||||
| Vrelište | 423,35 K 150,2 °C | |||||||||||||
| Tlak para | ||||||||||||||
| Topljivost u vodi |
topljiv u bilo kojem omjeru | |||||||||||||
| Dipolni moment |
2,26 D | |||||||||||||
| Struktura | ||||||||||||||
| Sigurnosne upute | ||||||||||||||
| ||||||||||||||
| SI-sustav mjernih jedinica korišten je gdje god je to moguće. Ukoliko nije drugačije naznačeno, upisane vrijednosti izmjerene su pri standardnim uvjetima. | ||||||||||||||
Vodikov peroksid (H2O2) je kemijski spoj vodika i kisika.
Svojstva i osobine
Bezbojna je i viskozna kapljevina, relativno stabilna na sobnoj temperaturi, ali se pri 80 °C egzotermno razlaže na vodu i kisik. Na sobnoj je temperaturi ta reakcija spora, a ubrzavaju ju nečistoće i svjetlost. Zbog toga se vodikov peroksid pohranjuje u tamnim bocama i uz dodatak inhibitora.
Djeluje i kao reducens, ali su oksidacijska svojstva jače izražena.
Dobivanje
Nastaje hidrogeniranjem antrakinona i oksidacijom nastaloga antrakinola.
Upotreba
Upotrebljava se za izbjeljivanje (ponajčešće kose), kao antiseptik, u kemijskoj industriji, a upotrebljavao se kao oksidans za raketno gorivo.
U prodaju dolazi u koncentracijama od 3,6,9,12, i 30% (takva koncentracija se naziva komercijalno i "Perhidrol").
Najčešće se koristi za dezinfekciju manjih rana i ogrebotina.[4]
Izvori
- Tehnički leksikon, Leksikografski zavod Miroslav Krleža; glavni urednik: Zvonimir Jakobović. Tiskanje dovršeno 21. prosinca 2007.g., Nacionalne i sveučilišne knjižnice u Zagrebu pod brojem 653717. ISBN 978-953-268-004-1, str. 969.
- ↑ • Nepoznat parametar:
first1
• Nepoznat parametar:last1
• Parametartypenije dopušten u klasijournal
• Parametardatenije dopušten u klasijournal - ↑ CRC Handbook of Chemistry and Physics, CRC Press, 2006.
- ↑ Morate navesti naslov = i url = dok rabite {{Citiranje web}},,
- ↑ • Parametar
accessdatenije dopušten u klasiweb


