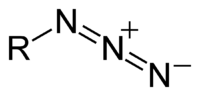Razlika između inačica stranice »Azidi«
(Bot: Automatski unos stranica) |
m (bnz) |
||
| Redak 1: | Redak 1: | ||
[[Datoteka:Azide-2D.png|mini|desno|200px|Azidna funkcionalna grupa]] | |||
'''Azidi''' (prema franc. ''azote'': [[Dušik|dušik]]), soli dušikovodične (azidne) kiseline, HN<sub>3</sub>. Azid je anion formule N<sub>3</sub><sup>−</sup>. | '''Azidi''' (prema franc. ''azote'': [[Dušik|dušik]]), soli dušikovodične (azidne) kiseline, HN<sub>3</sub>. Azid je anion formule N<sub>3</sub><sup>−</sup>. | ||
To je [[konjugirana baza]] [[Azidna kiselina|azidne kiseline]]. Azid je i funkcionalna grupa u organskoj kemiji, RN<sub>3</sub>. N<sub>3</sub><sup>−</sup> je linearni [[Anion|anion]] koji je [[Izoelektričnost|izoelektričan]] sa [[Ugljik dioksid|CO<sub>2</sub>]] i [[Dušični oksid|N<sub>2</sub>O]]. Po [[Teorija valentnih veza|teoriji valentnih veza]], azid se može opisati pomoću nekoliko rezonantnih struktura, od kojih je jedna bitnija <big>N<sup>−</sup>=N<sup>+</sup>=N<sup>−</sup></big>. | To je [[konjugirana baza]] [[Azidna kiselina|azidne kiseline]]. Azid je i funkcionalna grupa u organskoj kemiji, RN<sub>3</sub>. N<sub>3</sub><sup>−</sup> je linearni [[Anion|anion]] koji je [[Izoelektričnost|izoelektričan]] sa [[Ugljik dioksid|CO<sub>2</sub>]] i [[Dušični oksid|N<sub>2</sub>O]]. Po [[Teorija valentnih veza|teoriji valentnih veza]], azid se može opisati pomoću nekoliko rezonantnih struktura, od kojih je jedna bitnija <big>N<sup>−</sup>=N<sup>+</sup>=N<sup>−</sup></big>. | ||
Trenutačna izmjena od 15:13, 8. svibnja 2022.
Azidi (prema franc. azote: dušik), soli dušikovodične (azidne) kiseline, HN3. Azid je anion formule N3−. To je konjugirana baza azidne kiseline. Azid je i funkcionalna grupa u organskoj kemiji, RN3. N3− je linearni anion koji je izoelektričan sa CO2 i N2O. Po teoriji valentnih veza, azid se može opisati pomoću nekoliko rezonantnih struktura, od kojih je jedna bitnija N−=N+=N−.
Neorganski azidi
Azidi formiraju i kovalentne i ionske spojeve sa metalima. Natrijev azid, NaN3, je sol koja ima široku uporabu kao aktivator zračnih jastuka u automobilima putem sljedeće reakcije:
- 2 NaN3(s) → 2 Na(s) + 3 N2(g)
Olovni azid Pb(N3)2 se koristi kao inicijalni eksploziv. Kovalentni azidi su brojni, a jedan primjer je [Co(NH3)5N3]Cl2. Metalo-organski azid je trimetilsilil azid, koji se ponekad koristi kao bezvodni izvor N3−.
Azidi u biokemiji
Azidni anion je toksičan, djeluje inhibirajuće na funkciju citokrom c oksidaze na taj način što se ireverzibilno vezuje za hemov kofaktor, na sličan način kao što je proces vezivanja cijanidnog aniona. Azidne soli se koriste u proučavanju mutageneze.
Organski azidi
Organski azidi se koriste u korisnim organskim reakcijama. Terminalni dušik je blago nukleofilan. Azidi lako istiskuju molekularni dušik, svojstvo koje se koristi u mnogim reakcijama kao što je Staudingerova ligacija ili Curtisovo pregrađivanje ili na primjer u sintezi γ-imino-β-enamino estera. U azidno alkilnoj Huisgen cikloadiciji, organski azidi reagiraju kao 1,3-dipoli. Primjeri organskih azida su kemijski reagens fenil azid i antivirusni lijek Zidovudin. Jedan od uobičajenih azida je tosil azid ovdje u reakciji sa norborandienom u reakciji ubacivanja dušika.
Dutt-Wormall reakcija
Klasična metoda za sintezu azida je Dutt-Wormall reakcija u kojoj diazonij soli reagiraju sa sulfonamidima stvarajući diazoaminosulfinate koji hidrolizom daju azide i sulfinsku kiselinu.
Sigurnost
- Natrij azid je toksičan (LD50 oralno (štakori) = 27 mg/kg) i može biti apsorbiran kroz kožu. Energično reagira sa CS2, bromom, dušičnom kiselinom,dimetil sulfatom i cijelim nizom teških metala uključujući bakar i olovo. Natrij azid eksplozivno se raspada kada se zagrije do temperature 275 °C ili više. Koristi se kao izvor plina u zračnim jastucima.
- Poznat je i borov azid koji je pak prije služio prije kao punjenje u detonatorima (upaljačima). Jedan je od najosjetljivijih i najotrovnijih azida.
- Azidi se više ne proizvode sbog svojih mana, ali se jedino koristi olov azid, kao upaljač (detonator) na udar u metku.
- Azidi teških metala kao što je olovni azid su vrlo nestabilni inicijalni eksplozivi koji detoniraju zbog udara ili zagrijavanja.
- U reakciji sa vodom ili Brønstedovim kiselinama oslobađa se izuzetno toksična i eksplozivna azidna kiselina.
- Poznato je da natrij azid i polimerno vezani azidi kao reagensi reagiraju sa diklormetanom i kloroformom pri čemu formiraju diazidometan i triazidometan koji su nestabilni u otopinama visokih koncentracija. Različite razarajuće eksplozije su prijavljene kao posljedica koncentriranja reakcijske smjese pomoću rotacijskog isparivača.
- Azidi teških metala koji su visoko eksplozivni pod tlakom ili udarom nastaju kada otopinu natrijevog azida ili pare HN3 dođu u kontakt s teškim metalima ili njihovim solima. Azidi teških metala mogu se pod određenim uvjetima akumulirati, primjerice u metalnim cijevima i na metalnim dijelovima različite opreme (rotacijski isparivači, oprema za liofilizaciju, sustavi za hlađenje, cijevi za otpadne vode), što može dovesti do jakih eksplozija. Pojedini organski i kovalentni azidi klasificirani su kao jako eksplozivni i toksični (neorganski azidi kao neurotoksini, azidni ion kao inhibitor citokrom c oksidaze.
- Kruti jodoazid je eksplozivan i ne smije se pripremati bez otapala.